জৈব রসায়ন (Organic Chemistry) হলো রসায়নের একটি শাখা যা মূলত কার্বন এবং তার যৌগ নিয়ে আলোচনা করে। জৈব রসায়ন জীবন্ত পদার্থে কার্বন যৌগের গঠন, গুণাগুণ, রাসায়নিক বিক্রিয়া এবং সংশ্লেষণের অধ্যয়ন। এতে সাধারণত হাইড্রোজেন, অক্সিজেন, নাইট্রোজেন, সালফার এবং হ্যালোজেন ইত্যাদি পরমাণুর সাথেও কার্বনের যৌগ নিয়ে আলোচনা করা হয়।
জৈব রসায়ন জীববিজ্ঞান, ঔষধ, কৃষি এবং বিভিন্ন প্রকার রাসায়নিক শিল্পের ভিত্তি। এর মাধ্যমে আমরা জৈব যৌগগুলোর কার্যপ্রণালী এবং ব্যবহার সম্পর্কে জানতে পারি।
প্রশ্ন-১। জৈব রসায়ন কাকে বলে? (What is called Organic chemistry?)
উত্তরঃ রসায়ন বিজ্ঞানের যে শাখায় হাইড্রোকার্বন ও হাইড্রোকার্বন জাতকসমূহের রসায়ন অর্থাৎ গঠন, প্রস্তুতি, ধর্ম, শনাক্তকরণ প্রভৃতি বিষয় নিয়ে আলােচনা করা হয়, তাকে জৈব রসায়ন বলে।
প্রশ্ন-২। অ্যালকিন কাকে বলে? (What is called Alkene?)
উত্তরঃ কার্বন-কার্বন দ্বিবন্ধনীযুক্ত অ্যালিফেটিক হাইড্রোকার্বনসমূহকে অ্যালকিন বলে।
প্রশ্ন-৩। অসম্পৃক্ত জৈব যৌগ কাকে বলে?
উত্তরঃ যে সকল জৈব যৌগের মুক্ত শিকলে অন্তত দুটি কার্বন পরমাণু দ্বি-বন্ধন বা ত্রি-বন্ধন দ্বারা পরস্পরের সাথে যুক্ত থাকে তাদেরকে অসম্পৃক্ত জৈব যৌগ বলে। যেমন– ইথিন (ইথিলিন), ইথাইন (অ্যাসিটিলিন)।
প্রশ্ন-৪। অ্যালিসাইক্লিক জৈব যৌগ কাকে বলে?
উত্তরঃ যেসব জৈব যৌগ গঠনের দিক থেকে সাইক্লিক বা বলয়াকার, কিন্তু ধর্মের দিক থেকে অ্যালিফেটিক বা মুক্ত শিকল যৌগের মতো তাদের অ্যালিসাইক্লিক জৈব যৌগ বলে। যেমন, সাইক্লোপ্রোপেন, সাইক্লোবিউটেন, সাইক্লোহেক্সেন ইত্যাদি।
প্রশ্ন-৫। কার্বোসাইক্লিক (Carbocyclic) যৌগ কাকে বলে?
উত্তরঃ যে সকল চক্রাকার যৌগের অণুর মূলকাঠামো কেবল কার্বন পরমাণু দ্বারা গঠিত, তাদেরকে কার্বোসাইক্লিক বা হোমোসাইক্লিক যৌগ বলে।
প্রশ্ন-৬। নন বায়োডিগ্রেডেবল পদার্থ কি?
উত্তরঃ যে সকল পদার্থ মাটির প্রাকৃতিক উপাদান যেমন, ব্যাকটেরিয়া দ্বারা বিয়োজিত হয় না তাদেরকে নন বায়োডিগ্রেডেবল পদার্থ বলে। যেমন- পলিথিন।
প্রশ্ন-৭। বায়োপলিমার কাকে বলে?
উত্তরঃ যেসব কৃত্রিম পলিমার সূর্যের আলো এবং ব্যাকটেরিয় দ্বারা বিয়োজিত হয়, সেসব পলিমারকে বায়োপলিমার বলে। যেমন- স্টার্চ, সেলুলোজ, প্রোটিন, নিউক্লিক এসিড ইত্যাদি।
প্রশ্ন-৮। জৈব সঞ্চয় কাকে বলে?
উত্তরঃ পরিবেশের সজীব অংশের শরীরের মধ্যে ক্ষতিকারক অজীব অংশের উপাদান ক্রমশ সঞ্চিত হওয়ার ঘটনাকে জৈব বিবর্ধন বা জৈব সঞ্চয় বলে।
প্রশ্ন-৯। ক্লিমেনসন বিজারণ কাকে বলে? (What is Clemmensen reduction?)
উত্তরঃ যে বিজারণ বিক্রিয়ায় কার্বনাইল মূলক বিজারিত হয়ে সরাসরি মিথিলিন মূলকে পরিণত হয় অর্থাৎ অ্যালডিহাইড ও কিটোনের বিজারণ ঘটে হাইড্রোকার্বনে পরিণত হয় তাকে ক্লিমেনসন বিজারণ বলে।
প্রশ্ন-১০। মিশ্র ইথার কাকে বলে?
উত্তরঃ যে ইথার অণুতে অক্সিজেন পরমাণুর সঙ্গে দুটি ভিন্ন অ্যালকাইল মূলক যুক্ত থাকে, তাকে মিশ্র ইথার বলে। এদের সাধারণ সংকেত হলো R–O–R’।
প্রশ্ন-১১। জৈব যৌগের বিশুদ্ধতার মানদণ্ড বলতে কী বুঝ?
উত্তরঃ ধর্মের ভিত্তিতে কোনো জৈব যৌগের বিশুদ্ধতা নির্ণয় করা যায়, সেসব বৈশিষ্ট্যমূলক ধর্মকে জৈব যৌগের বিশুদ্ধতার মানদন্ড বলা হয়। যেমন কঠিন পদার্থের ক্ষেত্রে গলনাঙ্ক, তরল পদার্থের ক্ষেত্রে স্ফুটনাঙ্ক, প্রতিসরণাঙ্ক ইত্যাদি হচ্ছে বিশুদ্ধতার মানদন্ড।
প্রশ্ন-১২। টেফলনের মনোমারের সংকেত লেখো।
উত্তরঃ টেফলনের মনোমার হচ্ছে : CF2 = CF2 (টেট্রাফ্লোরোইথিন)।
প্রশ্ন-১৩। কার্বানায়ন কি?
উত্তরঃ কোনো জৈব পদার্থের অণুতে সমযোজী বন্ধনের বিষম ভাঙনের ফলে সৃষ্ট ঋণাত্মক চার্জযুক্ত কার্বন পরমাণুবিশিষ্ট আয়নকে কার্বানায়ন বলে।
প্রশ্ন-১৪। পার্শ্বশিকল কাকে বলে?
উত্তরঃ অ্যারোমেটিক বা বেনজিন নিউক্লিয়াস হতে এক বা একাধিক হাইড্রোজেন পরমাণু সমসংখ্যক কার্বন পরমাণু যুক্ত অ্যালিফেটিক মূলক দ্বারা প্রতিস্থাপিত হলে, উক্ত মূলককে পার্শ্বশিকল বলে।
প্রশ্ন-১৫। ইলেকট্রোফাইল কি? (What is Electrophile?)
উত্তরঃ যেসব বিকারক ইলেকট্রনের প্রতি আসক্তি প্রকাশ করে এবং বিক্রিয়ার সময় ইলেকট্রন গ্রহণ করে তাদেরকে ইলেকট্রনাকর্ষী বিকারক বা ইলেকট্রোফাইল বলে।
প্রশ্ন-১৬। অ্যালকাইল মূলক কাকে বলে?
উত্তরঃ সম্পৃক্ত হাইড্রোকার্বন বা অ্যালকেনের অণু থেকে একটি হাইড্রোজেন পরমাণুকে অপসারণ করলে যে একযােজী মূলক অবশিষ্ট থাকে তাকে অ্যালকাইল মূলক বলে।
প্রশ্ন-১৭। পেট্রোলিয়াম কি? (What is Petroleum?)
উত্তরঃ পেট্রোলিয়াম হচ্ছে তরল দাহ্য পদার্থ যা খনি থেকে পাওয়া যায়। পেট্রোলিয়াম জাতীয় পদার্থগুলো জৈব যৌগ যা প্রধানত কার্বন, হাইড্রোজেন ও অক্সিজেন দ্বারা গঠিত।
প্রশ্ন-১৮। অ্যারোমেটিক নিউক্লিয়াস কাকে বলে?
উত্তরঃ প্রত্যেক অ্যারোমেটিক যৌগই প্রত্যক্ষ বা পরোক্ষভাবে বেনজিন হতে গঠিত এবং এসব যৌগে সর্বদাই বেনজিন বলয় যুক্ত থাকে। ছয় কার্বন পরমাণুবিশিষ্ট বেনজিন বয়লকে অ্যারোমেটিক নিউক্লিয়াস বলে।
প্রশ্ন-১৯। ন্যাপথালিন কি?
উত্তরঃ ন্যাপথালিন হল বেনজিন বলয়যুক্ত অ্যারোমেটিক যৌগ। একে তাপ দিলে এটি সরাসরি ঊর্ধ্বপাতিত হয়।
প্রশ্ন-২০। কাপড় কাচার সাবান কাকে বলে?
উত্তরঃ কাপড়-চোপড় ধোয়ার জন্য টুকরো বা গোলবল আকারে যে সাবান পাওয়া যায় তাকে কাপড় কাচার সাবান বলে। এটিতে সাধারণত উদ্ভিজ্জ তেল থাকে না। এটি হলো তেল বা চর্বির সোডিয়াম লবণ।
প্রশ্ন-২১। নাইলন কি?
উত্তরঃ অ্যামাইডের পলিমারকে পলিঅ্যামাইড বলে। পলিঅ্যামাইড তন্তুময় পদার্থ। বাণিজ্যিকভাবে এ সাংশ্লেষিক তন্তু নাইলন নামে পরিচিত। যেমন, নাইলন-66।
প্রশ্ন-২২। স্যান্ডমেয়ার বিক্রিয়া কাকে বলে?
উত্তরঃ ডায়াজোনিয়াম লবণ হতে ক্লোরোবেনজিন বা ব্রোমোবেনজিন প্রস্তুত করার বিক্রিয়াকে স্যান্ডমেয়ার বিক্রিয়া (Sandmeyer reaction) বলে।
প্রশ্ন-২৩। হাকেল নীতি কি?
উত্তরঃ হাকেল নীতিটি হলো– অ্যারোমেটিক যৌগের অণুতে (4n + 2) সংখ্যক পাই (π) ইলেকট্রন থাকে। এখানে, n = 0, 1, 2, 3…… পূর্ণ সংখ্যা।
প্রশ্ন-২৪। কাইরাল কার্বন কি?
উত্তরঃ জৈব যৌগের অণুর ক্ষেত্রে কার্বন পরমাণুর সাথে চারটি পরস্পর সম্পূর্ণ ভিন্ন একযোজী পরমাণু বা মূলক যুক্ত থাকলে ঐ কার্বনকে কাইরাল কার্বন বলে।
প্রশ্ন-২৫। এনানসিওমার কাকে বলে?
উত্তরঃ যে আলোক সমাণুদ্বয় সমাবর্তিত আলোর তলকে একই আবর্তন কোণে পরস্পর বিপরীত দিকে আবর্তন করে তাদেরকে পরস্পরের এনানসিওমার বলে।
প্রশ্ন-২৬। গ্যামাক্সিন কি?
উত্তরঃ গ্যামাক্সিন হলো অ্যারোমেটিক হাইড্রোকার্বনের হ্যালোজেন জাতক যা কীটনাশক হিসেবে ব্যবহৃত হয়।
প্রশ্ন-২৭। জ্যামিতিক সমাণুতা কাকে বলে?
উত্তরঃ জৈব যৌগের কার্বন-কার্বন বন্ধনের অক্ষ বরাবর যুক্ত আবর্তন সম্ভব না হলে ভিন্ন কনফিগারেশন যুক্ত দুধরনের যৌগের সৃষ্টি হয় তাদেরকে জ্যামিতিক সমাণুতা বলে।
প্রশ্ন-২৮। জ্বালানি কাকে বলে?
উত্তরঃ যে সব পদার্থ থেকে বিক্রিয়ার মাধ্যমে প্রচুর পরিমাণে তাপশক্তি উৎপাদিত হয় তাদেরকে জ্বালানি বলে। যেমন- কাঠকয়লা, শুকনা কাঠ, কয়লা, পেট্রোলিয়াম জাতীয় পদার্থ, কোল গ্যাস, বায়োগ্যাস, LPG, LNG, CNG ইত্যাদি।
প্রশ্ন-২৯। কার্বিনল কি?
উত্তরঃ কার্বিনল হলো এক প্রকার প্রাইমারি অ্যালকোহল, যার সারধারণ সংকেত হচ্ছে RCH2OH।
প্রশ্ন-৩০। ফ্রি-রেডিক্যাল কাকে বলে?
উত্তরঃ বন্ধনের সুষম বিভাজনের ফলে সৃষ্ট পরমাণু বা মূলককে মুক্তমূলক বা ফ্রি রেডিক্যাল বলে।
প্রশ্ন-৩১। কার্বসাইক্লিক যৌগসমূহকে হোমোসাইক্লিক যৌগ বলা হয় কেন?
উত্তরঃ বলয়কার যৌগের বলয়টি যদি শুধুমাত্র কার্বন পরমাণু দ্বারা গঠিত হয় তখন তাকে কার্বসাইক্লিক বা হোমোসাইক্লিক যৌগ বলে। এখানে হোমো শব্দের অর্থ সম বা সমান প্রকৃতির যৌগ যা প্রত্যেক ক্ষেত্রে সমান হবে তাই কার্বসাইক্লিক যৌগসমূহকে হোমোসাইক্লিক যৌগ বলা হয়।
প্রশ্ন-৩২। রেসিমিক মিশ্রণ কি?
উত্তরঃ এনানসিওমারের সমমোলার মিশ্রণকে রেসিমিক মিশ্রণ বলা হয়।
প্রশ্ন-৩৩। নিউক্লিওফাইল কাকে বলে?
উত্তরঃ যে সকল বিকারক বিক্রিয়াকালে ধনাত্মক কেন্দ্র বা নিউক্লিয়াসের প্রতি আকৃষ্ট হয় এবং ইলেকট্রন দান করতে পারে তাদেরকে নিউক্লিওফাইল বলে। যেমন— X- (CI-, Br-), NH3 ইত্যাদি।
প্রশ্ন-৩৪। অ্যারোমেটিক যৌগ কাকে বলে?
উত্তরঃ যেসব বলয়াকার সমতলীয় জৈব যৌগের অণুতে সঞ্চারণশীল (4n + 2) সংখ্যক পাই (π) ইলেকট্রন থাকে, তাদেরকে অ্যারোমেটিক যৌগ বলে।
প্রশ্ন-৩৫। পলিমারকরণ কাকে বলে?
উত্তরঃ যে বিক্রিয়ায় একই যৌগের (যেমন : অসম্পৃক্ত হাইড্রোকার্বন) বহুসংখ্যক অণু পরপর যুক্ত হয়ে বৃহৎ অণু বিশিষ্ট নতুন যৌগ উৎপন্ন করে, সে বিক্রিয়াকে পলিমারকরণ বলে এবং উৎপন্ন যৌগকে পলিমার ও মূল যৌগকে মননামার বলে।
প্রশ্ন-৩৬। ডায়াজোটাইজেশন কাকে বলে?
উত্তরঃ যে প্রক্রিয়ায় প্রাইমারি অ্যারোমেটিক অ্যামিনকে 0°–5°C নিম্ন তাপমাত্রায় HCl/H2SO4 দ্রবীভূত করে, উক্ত দ্রবণে NaNO2 দ্রবণ যোগ করলে ডায়াজোনিয়াম লবণ উৎপন্ন হয়, তাকে ডায়াজোটাইজেশন বা ডায়াজো বিক্রিয়া বলে।
প্রশ্ন-৩৭। অক্সি-অ্যাসিটিলিন শিখা কাকে বলে?
উত্তরঃ অক্সিজেন ও অ্যাসিটিলিন গ্যাসকে একত্রে করলে উচ্চ তাপমাত্রা যুক্ত যে অনুজ্জ্বল শিখা উৎপন্ন হয় সে শিখাকে অক্সি-অ্যাসিটিলিন শিখা বলে। ধাতু গলাতে ও জোড়া লাগাতে এ শিখা ব্যবহৃত হয়।
প্রশ্ন-৩৮। বেনজিন চক্রে ওরিয়েন্টেশন কাকে বলে?
উত্তরঃ বেনজিন চক্রে দ্বিতীয় বা পরবর্তী প্রতিস্থাপন চক্রের কোন অবস্থানে ঘটবে তা আঙ্গিকভাবে জানার প্রক্রিয়াকে ওরিয়েন্টেশন বলে।
প্রশ্ন-৩৯। ভিনেগার কাকে বলে?
উত্তরঃ ইথায়নিক এসিডের (CH3COO) 6-10% জলীয় দ্রবণকে ভিনেগার বলে।
প্রশ্ন-৪০। পেপটাইড বন্ধন কাকে বলে?
উত্তরঃ এক অণু অ্যামাইনো এসিডের কার্বক্সিল মূলকের -OH ও অপর এক অণু অ্যামাইনো এসিডের –NH2 মূলকের একটি হাইড্রোজেন পরমাণু মিলে পানি অপসারিত হয়ে যে অ্যামাইড গঠিত হয় তাতে সৃষ্ট বন্ধনকে পেপটাইড বন্ধন বলে।
প্রশ্ন-৩৯। টেফলন কি? (What is Teflon?)
উত্তরঃ টেফলন হলো টেট্রাফ্লোরো ইথিলিনের পলিমার যা বিদ্যুৎ, তাপ, ও রাসায়নিক পদার্থ প্রতিরোধী এবং কম পরিমাণে জলীয় বাষ্প শোষণ করে বলে ইনস্যুলেটর, বৈদ্যুতিক যন্ত্রাংশ উৎপাদনে অনেক বেশি ব্যবহৃত হয়।
প্রশ্ন-৪০। অ্যালিফেটিক অ্যামিন কাকে বলে?
উত্তরঃ অ্যামোনিয়া (NH3) থেকে হাইড্রোজেন (H) পরমাণু অ্যালিফেটিক হাইড্রোকার্বন মূলক যেমন অ্যালকাইল মূলক দ্বারা প্রতিস্থাপিত হলে উৎপন্ন অ্যামিনকে অ্যালিফেটিক অ্যামিন বলে।
প্রশ্ন-৪১। অর্থো-প্যারা নির্দেশক গ্রুপ কাকে বলে?
উত্তরঃ যেসব গ্রুপ বেনজিন বলয়ে উপস্থিত থাকলে আগত দ্বিতীয় প্রতিস্থাপক গ্রুপ বেনজিন বলয়ের অর্থো ও প্যারা অবস্থানে প্রবেশ করে তাদেরকে অর্থো-প্যারা নির্দেশক গ্রুপ বলে।
প্রশ্ন-৪২। হেক্সামিন কাকে বলে?
উত্তরঃ হেক্সামিথিলিন টেট্রামিন বা ইউরোট্রপিন নামক সাদা বর্ণের চাক্রিক অ্যামিনকে হেক্সামিন বলে।
প্রশ্ন-৪৩। সাবানায়ন কাকে বলে?
উত্তরঃ ক্ষার দ্রবণ সহযোগে তৈল বা চর্বিকে আর্দ্র বিশ্লেষিত করে সাবান প্রস্তুত করার প্রক্রিয়াকে সাবানায়ন বলে।
প্রশ্ন-৪৪। উচ্চ পলিমার কাকে বলে?
উত্তরঃ উচ্চ আণবিক ভরবিশিষ্ট পলিমারকে উচ্চ পলিমার বলে।
প্রশ্ন-৪৫। প্রাকৃতিক পলিমার কাকে বলে?
উত্তরঃ সাধারণভাবে প্রকৃতি অর্থাৎ উদ্ভিদ ও প্রাণী থেকে প্রাপ্ত পলিমারকে প্রাকৃতিক পলিমার বলে।
প্রশ্ন-৪৬। ফুলারিন্স কাকে বলে?
উত্তরঃ কার্বন পরমাণু sp2 সংকরিত অবস্থায় 30-70 টি পরস্পর সমযোজী বন্ধনে যুক্ত হয়ে বিভিন্ন আকৃতির গঠন তৈরি করে। কার্বনের এ রূপভেদগুলোকে ফুলারিন্স বলে।
প্রশ্ন-৪৭। দ্রাবক নিষ্কাশন কাকে বলে?
উত্তরঃ যে প্রক্রিয়ায় কোনো দ্রাবকে একাধিক পদার্থের একটি দ্রবণ থেকে অন্য কোনো উপযুক্ত দ্রাবকে দ্রবীভূত করে মিশ্রণের একটি নির্দিষ্ট পদার্থকে পৃথক করা হয় তাকে দ্রাবক নিষ্কাশন বলে।
প্রশ্ন-৪৮। হেটারোসাইক্লিক যৌগ কাকে বলে?
উত্তর : যেসব বৃত্তাকার যৌগের বলয় গঠনে কার্বন পরমাণুসহ অপর কোন ভিন্ন মৌলের পরমাণু বা হেটারো পরমাণু যেমন O, S, N প্রভৃতির এক বা একাধিক পরমাণু অংশগ্রহণ করে তাদের হেটারোসাইক্লিক যৌগ বলে।
ফারমেন্টেশন এর অর্থনৈতিক গুরুত্ব কি?
উত্তরঃ নিচে ফারমেন্টেশন এর অর্থনৈতিক গুরুত্ব দেয়া হলো–
১. অ্যালকোহল বা মদ তৈরিতে ব্যবহৃত হয়।
২. দুধ থেকে দই তৈরিতে ব্যবহৃত হয়।
৩. ভিনেগার তৈরিতে ব্যবহৃত হয়।
৪. পাউরুটি, বিস্কুট, কেক তৈরিতে ব্যবহৃত হয়।
৫. নানা রকম খাদ্যবস্তু এবং বিভিন্ন শিল্পে রাসায়নিক দ্রব্য উৎপাদনে ব্যবহৃত হয়।
মিথান্যালের ব্যবহার লিখ।
উত্তরঃ মিথান্যালের ব্যবহারসমূহঃ
i. পলিমিথান্যালকে ডেলরিন নামে বাজারে পাওয়া যায়। এটি খুব শক্ত প্লাস্টিক। তাই কাঠ ও ধাতুর বিকল্প হিসাবে একে ব্যবহার করা হয়।
ii. ট্রাইঅক্সেন বা মিথান্যাল ট্রাইমারকে গ্যাসীয় মিথান্যালের উৎস হিসেবে এবং প্লাস্টিক দ্রব্য প্রস্তুতিতে ব্যবহার করা হয়।
ক্লোরো বেনজিনে ক্লোরিন পরমাণু অর্থো প্যারা নিদের্শক কেন?
উত্তরঃ বেনজিন বলয়ে যে সকল মূলকসমূহ আগমনকারী দ্বিতীয় মূলকটিকে অর্থো এবং প্যারা অবস্থানে প্রবেশের জন্য ক্ষেত্র প্রস্তুত করে বা নির্দেশ দেয় সেই সকল মূলক অর্থো প্যারা নির্দেশক। দেখা যায় যে, ক্লোরিন পরমাণু ক্লোরোবেনজিনে অর্থো প্যারা অবস্থানে মুক্ত হয়। অর্থাৎ ক্লোরিন অর্থো প্যারা নির্দেশক।
অ্যালকোহল পানিতে দ্রবণীয় কেন?
উত্তরঃ অ্যালকোহল পানিতে দ্রবীভূত হয়। কারণ অ্যালকোহলের অণুর কাঠামো হতে দেখা যায় যে, এর অণুতে -OH মূলক বর্তমান। -OH মূলকের H পরমাণু পানির O পরমাণুর সাথে সহজেই H- বন্ধন গঠন করে । H-বন্ধনের কারণে সৃষ্ট আকর্ষণ বল অ্যালকোহলের অণুগুলোকে পানিতে দ্রবীভূত করতে মূখ্য পালন করে।
সাইক্লোহেক্সেন কি অ্যারোমেটিক যৌগ- ব্যাখ্যা করো।
উত্তরঃ সাইক্লোহেক্সেন অ্যারোমেটিক যৌগ নয়। কেননা, সাইক্লোহেক্সেনের কাঠামো বলয়টি শুধু কার্বন পরমাণু দ্বারা গঠিত এবং এদের মধ্যে কোনো দ্বিবন্ধন থাকে না অর্থাৎ সঞ্চারণশীল π-ইলেকট্রন নেই।
তাই এটি অ্যারোমেটিক যৌগ হতে পারে না। কেননা অ্যারোমেটিক যৌগ হতে হলে কার্বন-কার্বন দ্বিবন্ধন ও (4n + 2) সংখ্যক π-ইলেকট্রন থাকতে হবে। তাই, সাইক্লোহেক্সেন অ্যারোমেটিক যৌগ নয়।
প্রশ্ন-৪৭। প্রোপিনের অসম্পৃক্ততা কীভাবে প্রমাণ করবে?
উত্তরঃ প্রোপিনের অসম্পৃক্ততা প্রমাণের পরীক্ষা নিম্নে দেওয়া হলো: ক্ষারীয় 2% পটাশিয়াম পারম্যাঙ্গানেট (KMnO4) লালচে বেগুনী বর্ণযুক্ত দ্রবণ। শীতল ও লঘু এ বেগুনি বর্ণের দ্রবণ প্রোপিনের সাথে বিক্রিয়া করে দ্রুত বর্ণহীন দ্রবণে পরিণত হয়। পরীক্ষণটিকে বেয়ার পরীক্ষা বলে।
এভাবে ক্ষারীয় KMnO4 দ্রবণ বর্ণহীনতা দেখে প্রোপিনের অসম্পৃক্ততা প্রমাণ করা হয়।
X হলো তিন কার্বনবিশিষ্ট একটি জৈব যৌগ যা জারিত হয়ে Y উৎপন্ন করে। Y যৌগটি 2,4-DNP এর সাথে বিক্রিয়ায় হলুদ অধঃক্ষেপ উৎপন্ন করে। Y ফেহলিং দ্রবণের সাথে বিক্রিয়া করে না।
এখানে, 'A' ছয় কার্বনবিশিষ্ট প্রাইমারি অ্যারেমেটিক অ্যামিন।
জৈব রসায়ন হলো জীবিত প্রাণীর রাসায়নিক উপাদান ও প্রক্রিয়া নিয়ে অধ্যয়ন। এটি প্রধানত কার্বন-ভিত্তিক যৌগসমূহের গঠন, গুণাবলি, বিক্রিয়া, এবং কার্যকারিতা নিয়ে কাজ করে। জীবের কাঠামো, বিপাক, এবং জৈবিক কার্যকলাপের সব স্তরে জৈব রসায়ন অপরিহার্য।
কার্বোহাইড্রেট:

জৈব রসায়ন জীবনের সব ক্ষেত্রে একটি মূল ভিক্তি সরবরাহ করে, যা মানবকল্যাণ এবং প্রাকৃতিক ভারসাম্য রক্ষার জন্য অত্যন্ত গুরুত্বপূর্ণ।
হাইড্রোজেন ও কার্বন দ্বারা গঠিত হাইড্রোকার্বন এবং হাইড্রোকার্বন থেকে উদ্ভূত যৌগসমূহকে জৈব যৌগ বলে।
এই বৈশিষ্ট্যগুলির জন্যই কার্বন জৈব রসায়নের কেন্দ্রবিন্দু এবং জীবনের প্রধান নির্মাণ উপাদান হিসেবে বিবেচিত হয়।
কর্বনের পারমাণবিক সংখ্যা 6, কার্বনের ইলেকট্রন বিন্যাস থেকে জানা যায় কার্বনের প্রথম কক্ষে 2টি এবং বাইরের কক্ষে 4টি ইলেকট্রন আছে । কার্বন পরমাণু বাইরের কক্ষের 4টি ইলেকট্রন, অন্য পরমাণুর বাইরের কক্ষের ইলেকট্রনের সঙ্গে চারটি ইলেকট্রন জোড় গঠন করে সমযোজ্যতা দ্বারা জৈব যৌগ উৎপন্ন করে ।
যেমন— মিথেন : জৈব যৌগের সরলতম যৌগ হল মিথেন (Methane) । যৌগটির সংকেত হল CH4 । এখানে কার্বন পরমাণুর সর্ববহিঃস্থ কক্ষে ইলেকট্রনগুলি চারটি হাইড্রোজেন পরমাণুর সহিত যুক্ত হয়েছে । এর গঠন হল -
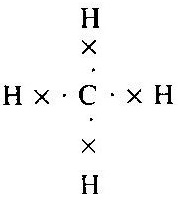
কার্বন পরমাণু আয়নীয় অর্থাৎ তড়িৎ-যোজী যৌগ উৎপন্ন করে না । কার্বন-কার্বন সমযোজ্যতা বন্ধন খুবই শক্তিশালী । অনেকগুলি কার্বন পরমাণু পরস্পরের সঙ্গে সমযোজ্যতা বন্ধন দিয়ে আবদ্ধ হয়ে দীর্ঘ কার্বন শৃঙ্খল উৎপন্ন করতে পারে । কার্বন পরমাণুগুলির নিজেদের মধ্যে যুক্ত হওয়ার এই ধর্মকে কার্বনের ক্যাটিনেশন (Catenation) বলে ।
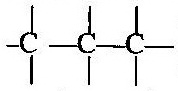
ক্যাটিনেশন (Catenation) :- যে ধর্মের জন্য কার্বন পরমাণুগুলি পরস্পর সমযোজী বন্ধনের (এক-বন্ধন, দ্বি-বন্ধন, ত্রি-বন্ধন) সাহায্যে পরস্পর যুক্ত হয়ে সুস্থিত কার্বন শৃঙ্খল গঠন করে, কার্বন পরমাণুর সেই বিশেষ ধর্মকে ক্যাটিনেশন বলে ।
একাধিক কার্বন পরমাণু এক-বন্ধন (-) (single bond), দ্বি-বন্ধন (=) (double bond) বা ত্রি-বন্ধন (≡) (triple bond) দ্বারা পরস্পর যুক্ত হয়ে বিভিন্ন জৈব যৌগ গঠন করতে পারে ।
[i] এক-বন্ধন (-) (singl bond):- যেমন, ইথেন অণুতে -
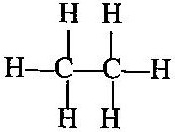
এবং একই রূপে ইথাইল অ্যালকোহলে কার্বন-কার্বন পরমাণুর মধ্যে এক-বন্ধন সৃষ্টি হয়ছে ।
[ii] দ্বি-বন্ধন (=) (double bond):- যেমন ইথিলিন অণুতে দ্বি-বন্ধন দেখা যায় অর্থাৎ কার্বন-কার্বন পরমাণুর মধ্যে দ্বি-বন্ধন সৃষ্টি হয়ছে । 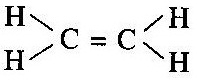
[iii] ত্রি-বন্ধন (≡) (triple bond):- যেমন অ্যাসিটিলিন অণুতে ত্রি-বন্ধন অর্থাৎ কার্বন-কার্বন পরমাণুর মধ্যে ত্রি-বন্ধন সৃষ্টি হয়ছে ।
H - C ≡ C - H
কিন্তু অজৈব যৌগের মধ্যে বন্ধন আয়নীয় ও সমযোজী দুটিই হতে পারে । অজৈব যৌগ সাধারণত আয়ানীয় বন্ধন দ্বারা যুক্ত : যেমন-NaCl, KCl, MgBr2, CaCl2 ইত্যাদি । কিন্তু কিছু কিছু অজৈব যৌগ আছে যারা সমযোজ্যতার দ্বারা যুক্ত হলেও আয়োনীয় যৌগের মতো ব্যবহার করে : যেমন- NH3, HCl, H2O, CO2 ইত্যাদি ।
দুটি হাইড্রোজেন পরমাণুর মধ্যে দুটি ইলেকট্রন শেয়ারের মাধ্যমে একটি হাড্রোজেন অণুর (H2) সৃষ্টি
সমযোজী বন্ধন (ইংরেজি: Covalent bond) হল এমন এক ধরনের রাসায়নিক বন্ধন যেখানে পরমাণুসমূহ তাদের নিজেদের মধ্যে ইলেকট্রন শেয়ারের বা ভাগাভাগির মাধ্যমে আবদ্ধ থাকে। এই ইলেক্ট্রন জোড়াগুলি ভাগ করা জোড়া বা বন্ধন জোড়া হিসাবে পরিচিত , এবং পরমাণুর মধ্যে আকর্ষণ এবং বিকর্ষণকারী শক্তির স্থিতিশীল ভারসাম্য, যখন বজায় থাকে তখন তাকে সমযোজী বন্ধন বলা হয়। ইলেকট্রন শেয়ার করা পরমাণুদ্বয়ের মধ্যেকার আকর্ষণ ও বিকর্ষণের ফলে যে সুস্থিত ভারসাম্য বল তৈরি হয় তাই সমযোজী বন্ধনের সৃষ্টি করে। অনেক অণু ইলেকট্রনের এই শেয়ারিং এর ফলে প্রতিটি পরমাণুকে একটি স্থিতিশীল ইলেকট্রনিক কনফিগারেশনের সাথে মিল রেখে একটি সম্পূর্ণ ভ্যালেন্স শেল এর সমতুল্য শক্তি অর্জন করতে সাহায্য করে। জৈব রসায়নে, সমযোজী বন্ধন আয়নিক বন্ধনের তুলনায় অনেক বেশি সাধারণ।
সমযোজী বন্ধন এদের গঠনের ধরন অনুযায়ী পাই-বন্ধন (π-বন্ধন), সিগমা বন্ধন (σ-বন্ধন),ধাতু-থেকে-ধাতু বন্ধন, অ্যাগস্টিক মিথস্ক্রিয়া,বাঁকানো বন্ধন এবং ত্রিকেন্দ্রীক দ্বিইলেক্ট্রন বন্ধন এবং ত্রিকেন্দ্রীক চার-ইলেক্ট্রন বন্ধন ইত্যাদি ধরনের হয়ে থাকে। সমযোজী বন্ধন শব্দটির প্রচলন ১৯৩৯ সাল থেকে শুরু হয়।
পরমাণুসমুহের মধ্যে সমযোজী বন্ধন তখনই গঠিত হয় যখন এদের তড়িৎ ঋণাত্মকতার মান সমান বা অতি নিকটবর্তী হয়। শেয়ারকৃত ইলেকট্রন যদি দুটি পরমাণুর মধ্যে নির্দিষ্ট না থেকে অনেকগুলি পরমাণু দ্বারা শেয়ার হয়ে থাকে তখন একে ডিলোকালাইজড ইলেকট্রন বলা হয়।আর সমযোজী বন্ধনে আবদ্ধ যৌগ পানিতে দ্রবণীয় নয়, তবে যেসকল সমযোজী বন্ধনে আবদ্ধ যৌগের মৌলগুলোর তড়িৎ ঋণাত্মকতার মান বেশি তারা পোলার যৌগ গঠন করে যার কারণে এরা পানিতে দ্রবণীয় হয়।
আধুনিক অরবিটাল অধিক্রমণ মতবাদটি রাসায়নিক বন্ধন গঠনের একটি উন্নত ধারণা, যা অরবিটালগুলোর অধিক্রমণের মাধ্যমে ইলেকট্রন শেয়ারিং ব্যাখ্যা করে। ইহা কোভ্যালেন্ট বন্ধনের ভিত্তি প্রদান করে এবং মলিকিউলগুলোর গঠন ও বৈশিষ্ট্য ব্যাখ্যা করতে ব্যবহৃত হয়।
এই মতবাদ অনুসারে, একাধিক পরমাণুর অরবিটাল একত্র হয়ে নতুন এক অরবিটাল তৈরি করে, যা পরমাণুগুলোকে একসঙ্গে ধরে রাখে।
১. সিগমা (σ) বন্ধন:
সিগমা বন্ধন হল সেই ধরনের বন্ধন যেখানে দুই পরমাণুর অরবিটালগুলি সরাসরি (head-to-head) অধিক্রমণ করে। এটি সবচেয়ে শক্তিশালী বন্ধন এবং সাধারণত একক বন্ধনে পাওয়া যায়।
উদাহরণ: H₂ অণু।
২. পাই (π) বন্ধন:
পাই বন্ধন হল সেই ধরনের বন্ধন যেখানে দুই পরমাণুর অরবিটালগুলি পাশ থেকে (sideways) অধিক্রমণ করে। এটি সিগমা বন্ধনের তুলনায় দুর্বল।
উদাহরণ: ডাবল বন্ধনে এক সিগমা এবং এক পাই বন্ধন থাকে, যেমন: O₂ অণু।
৩. ডেল্টা (δ) বন্ধন:
ডেল্টা বন্ধন গঠিত হয় d-অরবিটালগুলোর অধিক্রমণের মাধ্যমে। এটি কিছু বিশেষ ক্ষেত্রে দেখা যায়, যেমন মেটাল-মেটাল বন্ধনে।
পারমাণবিক অরবিটাল সংকরণ
পারমাণবিক অরবিটাল সংকরণ (Hybridization) হলো একাধিক ভিন্ন শক্তিস্তরের অরবিটালের মিলন, যার ফলে নতুন এবং সমান শক্তিসম্পন্ন অরবিটাল তৈরি হয়। এই প্রক্রিয়ায় সংশ্লিষ্ট অরবিটালগুলো নির্দিষ্ট জ্যামিতিক আকৃতি ধারণ করে।
১. এসপি³ সংকরণ:
২. এসপি² সংকরণ:
৩. এসপি সংকরণ:
কার্বনের চতুর্যোজ্যতা
কার্বনের চতুর্যোজ্যতা হলো চারটি ভিন্ন পরমাণুর সঙ্গে সমানভাবে বন্ধন গঠনের ক্ষমতা।
১. এসপি³ সংকরণে চতুর্যোজ্যতা:
২. এসপি² সংকরণে চতুর্যোজ্যতা:
৩. এসপি সংকরণে চতুর্যোজ্যতা:
কার্বনের বহুমুখিতা
কার্বনের চতুর্যোজ্যতার কারণে এটি জৈব রসায়নে গুরুত্বপূর্ণ ভূমিকা পালন করে। কার্বন বিভিন্ন ধরণের যৌগ যেমন চেইন, শাখা এবং চক্রাকারে বন্ধন গঠন করতে পারে।
কার্বনের sp^3 সংকরণ:
কার্বনের পারমাণবিক গঠনে ১টি 2s অরবিটাল এবং ৩টি 2p অরবিটাল থাকে। sp^3 সংকরণে এই অরবিটালগুলো একত্রে মিশে চারটি সমান শক্তিসম্পন্ন নতুন sp^3 সংকরণিত অরবিটাল তৈরি করে।
মিথেন অণু গঠন (CH4)1:
মিথেন অণুতে একটি কার্বন পরমাণু চারটি হাইড্রোজেন পরমাণুর সাথে একক কোভ্যালেন্ট বন্ধনের মাধ্যমে যুক্ত হয়।
গুরুত্বপূর্ণ বৈশিষ্ট্য:
CH₃C≡CH
CH₃CH₂CH₃
CH₂ =C=CH₂
CH₂ =C=CH
একটি s অরবিটাল এবং দুটি p অরবিটাল সংমিশ্রিত হয়ে তিনটি সমশক্তিসম্পন্ন নতুন অরবিটাল উৎপন্ন হওয়ার প্রক্রিয়াকে sp সংকরণ বা sp2 Hybridization বলে।
কার্বন পরমাণুর ইলেকট্রন বিন্যাস নিম্নরূপ
C(12) 1s2 2s2 2px1 2py1 2pz (সাধারণ অবস্থায়)।
C (0) – 182 1s1 2px1 2py1 2pz1 (উত্তেজিত অবস্থায়)
sp2 সংকর অরবিটাল তিনটি একই সমতলে অবস্থান করে এবং পরস্পরের সাথে 120° কোণে উৎপন্ন করে। sp2 সংকর অরবিটাল গঠনের পর প্রত্যেক কার্বনের একটি করে 2p2 অরবিটাল অসংকরিত বা বিশুদ্ধ অবস্থায় থাকে। প্রত্যেকটি sp সংকর অরবিটালে 33.3% S চরিত্র ও 66.7% p চরিত্র থাকে।
ইথিলিন (HC2 = CH2) অণু গঠনকালে কার্বন পরমাণুদ্বয়ের প্রত্যেকটির একটি করে sp2 সংকর অরবিটাল পরপর অধিক্রমণ করে একটি sp2 sp2 (C-C) সিগমা বন্ধন সৃষ্টি করে। পরে প্রতিটি কার্বন পরমাণুর অবশিষ্ট দুটি করে মোট চারটি sp2 সংকর অরবিটালের প্রতিটির সাথে একটি করে H পরমাণুর 1s অরবিটালের অধিক্রমণ দ্বারা চারটি sp2 – s (C – H) সিগমা বন্ধন সৃষ্টি হয়। অসংকরিত 2p2 অরবিটালের লোব দুটি সমতলের উপরে ও নীচে পরস্পর সমান্তরালভাবে অবস্থান করে এরা পাশাপাশি অধিক্রমণের মাধ্যমে কার্বন-কার্বন বন্ধন গঠন করে।
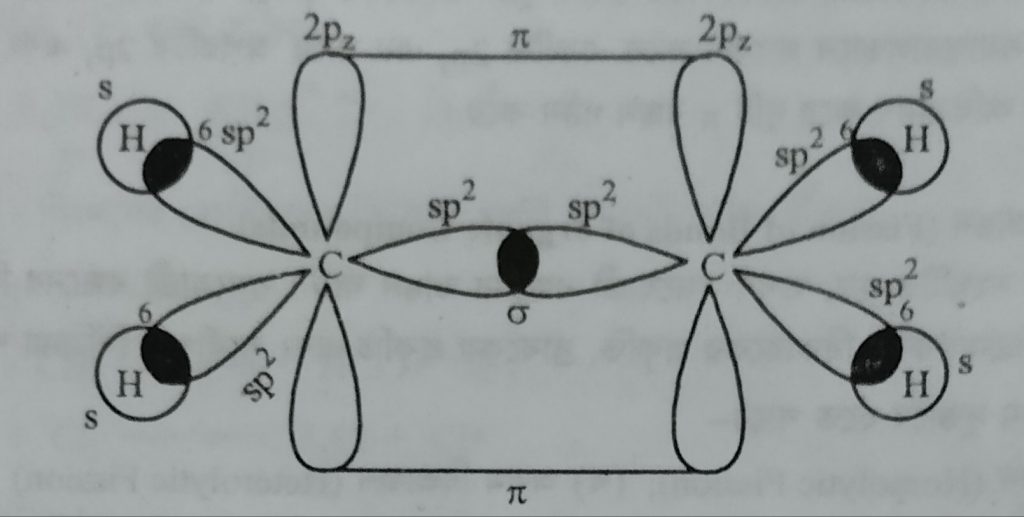
ইথিলিন অনুর অরবিটাল চিত্র।
কার্বনের sp সংকরণ তখন ঘটে যখন একটি s অরবিটাল এবং একটি p অরবিটাল পরস্পরের সাথে মিশে গিয়ে দুটি sp হাইব্রিড অরবিটাল তৈরি করে। এই প্রক্রিয়ায়:
ইথাইন বা অ্যাসিটিলিন (C₂H₂) হলো এক ধরনের অ্যালকাইন, যেখানে কার্বন-কার্বন ত্রিবন্ধন (triple bond) উপস্থিত। এটি sp সংকরণের একটি গুরুত্বপূর্ণ উদাহরণ।
sp সংকরণ কার্বনের বিশেষ গুণাবলীর মধ্যে একটি, যা ইথাইনের মতো ত্রিবন্ধনযুক্ত অণুর গঠনকে সম্ভব করে। ইথাইনের লিনিয়ার গঠন এবং শক্তিশালী ত্রিবন্ধন এর রাসায়নিক বৈশিষ্ট্যের একটি গুরুত্বপূর্ণ অংশ।
| অণু | গঠন | বন্ধন কোণ | C-C বন্ধন দূরত্ব | C-H বন্ধন দূরত্ব |
|---|---|---|---|---|
| ইথেন | সম্পৃক্ত | \( 109.5^\circ \) | 1.54 Å | 1.09 Å |
| ইথিন | ডাবল বন্ধন | \( 120^\circ \) | 1.33 Å | 1.08 Å |
| ইথাইন | ত্রিগুণ বন্ধন | \( 180^\circ \) | 1.20 Å | 1.06 Å |
এই তিনটি অণু তাদের গঠনে থাকা বন্ধনের সংখ্যার ভিত্তিতে ভিন্ন বন্ধন কোণ এবং বন্ধন দূরত্ব প্রদর্শন করে।
একই শ্রেণিভুক্ত যৌগসমূহকে তাদের ক্রমবর্ধমান আণবিক ভর অনুযায়ী (অণুস্থিত কার্বন পরমাণু সংখ্যার ক্রমবৃদ্ধি) সাজালে দেখা যায় যে, ঐ শ্রেণির অন্তর্গত যে কোনো দুটি নিকটতম পাশাপাশি যৌগের সংকেতের মধ্যে সর্বদা একটি -CH2- (মিথিলিন) মূলকের ব্যবধান থাকে যাদের একটি সাধারণ প্রস্তুত প্রণালীতে প্রস্তুত করা যায় এবং একটি সাধারণ সংকেতের সাহায্যে প্রকাশ করা যায়, ভৌত ধর্মে নিয়মিত ক্রম এবং রাসায়নিক ধর্মে সাদৃশ্য দেখা যায়। –CH2– মূলক পার্থক্য বিশিষ্ট এরূপ সমধর্মী যৌগসমূহের এক একটি শ্রেণিকে সমগোত্রীয় শ্রেণি (Homologous Series) বলে।
সমগোত্রীয় শ্রেণির বৈশিষ্ট্য (Characteristics Homologous Series)
সাধারণভাবে সমগোত্রীয় শ্রেণির যৌগসমূহের বৈশিষ্ট্যসমূহ নিম্নরূপ–
এ সম্পর্কিত বহুনির্বাচনি প্রশ্ন ও উত্তরঃ–
১। সমগোত্রীয় শ্রেণিভুক্ত সদস্যকে কী বলে?
ক) সমগোত্রক
খ) অসমগোত্রক
গ) হোমোসাইক্লিক
ঘ) হেটারোলোগাস
সঠিক উত্তর : ক) সমগোত্রক
২। হেপ্টানোন এর সমগোত্রীয় শ্রেণির নাম কি?
ক) অ্যালডিহাইড
খ) ইথার
গ) অ্যালকোহল
ঘ) কিটোন
সঠিক উত্তর : ঘ) কিটোন
৩। আণবিক ভর বৃদ্ধির সাথে সাথে সমগোত্রীয় শ্রেণির ভৌত ধর্ম–
ক) হ্রাস পায়
খ) বৃদ্ধি পায়
গ) ক্রমানুসারে পরিবর্তন ঘটে
ঘ) অপরিবর্তিত থাকে
সঠিক উত্তর : গ) ক্রমানুসারে পরিবর্তন ঘটে
৪। মিথানলের স্ফুটনাঙ্ক কত?
ক) 65°C
খ) 60°C
গ) 62°C
ঘ) 64°C
সঠিক উত্তর : ক) 65°C
জৈব যৌগের কার্যকরী মূলকের ভিত্তিতে শ্রেণিকরণ তাদের রাসায়নিক বৈশিষ্ট্য ও প্রক্রিয়া বোঝার জন্য গুরুত্বপূর্ণ। এটি জৈব রসায়নের বিভিন্ন ক্ষেত্রে প্রয়োগযোগ্য।
-CN
-CONH2
(-CO)2O
-CO-
কার্বন শিকলে একক সিগমা বন্ধনযুক্ত মুক্ত শিকল হাইড্রোকার্বনকে অ্যালকেন বলে। এরা রাসায়নিকভাবে অনেক কম সক্রিয় থাকে বলে এদেরকে প্যারাফিনও বলা হয়।
C1 – C4 = প্রাকৃতিক গ্যাস, এল পি গ্যাস
C5-C6 = লাইট পেট্রোলিয়াম
C5-C10 = গ্যাসোলিন (পেট্রোল)
C11-C16 = কেরোসিন
C17-C20 = ডিজেল
C15-C18 = লুব্রিকেটিং অয়েল
C20-C30 = প্যারাফিন ওয়াক্স
C30 এর উর্ধ্বে = বিটুমিন
অ্যালকেন হলো এমন এক ধরনের সম্পৃক্ত হাইড্রোকার্বন যেখানে কার্বনের মধ্যে শুধুমাত্র একক বন্ধন (single bond) বিদ্যমান। এর সাধারণ রাসায়নিক সংকেত \( C_nH_{2n+2} \)। অ্যালকেনের নামকরণ আন্তর্জাতিক ইউনিয়ন অব পিওর অ্যান্ড অ্যাপ্লাইড কেমিস্ট্রি (IUPAC)-এর নিয়ম অনুসারে করা হয়।
অসম্পৃক্ত হাইড্রোকার্বন হলো সেই যৌগসমূহ, যেগুলোর কাঠামোতে একটি বা একাধিক কার্বন-কার্বন ডাবল বা ট্রিপল বন্ড থাকে। এদের নামকরণে IUPAC নিয়ম অনুসরণ করা হয়। অসম্পৃক্ত হাইড্রোকার্বন প্রধানত দুই ধরনের হয়:
কাঠামোতে এমন সবচেয়ে দীর্ঘ শৃঙ্খল নির্বাচন করুন, যাতে ডাবল বা ট্রিপল বন্ড অন্তর্ভুক্ত থাকে। এই শৃঙ্খলের নাম হবে মূল নাম।
কার্বন পরমাণুগুলো এমনভাবে নম্বরায়ণ করুন, যাতে ডাবল বা ট্রিপল বন্ডটি সবচেয়ে ছোট নম্বর পায়।
ডাবল বন্ডের জন্য -ene এবং ট্রিপল বন্ডের জন্য -yne ব্যবহার করুন। শৃঙ্খলে একাধিক ডাবল বা ট্রিপল বন্ড থাকলে, তাদের সংখ্যা বোঝাতে di-, tri-, tetra- ইত্যাদি ব্যবহার করুন।
ডাবল বা ট্রিপল বন্ডের অবস্থান সংখ্যা দিয়ে দেখাতে হবে। সংখ্যাটি মূল নামের আগে যুক্ত হবে।
প্রধান শৃঙ্খলের সঙ্গে যুক্ত শাখাগুলোর নাম আলকাইল গ্রুপ হিসেবে উল্লেখ করুন এবং তাদের অবস্থান নম্বর দিয়ে নির্ধারণ করুন।
এই নিয়ম অনুসরণ করে অসম্পৃক্ত হাইড্রোকার্বনের নামকরণ সহজে করা যায়।
নামকরণের এই নিয়ম IUPAC পদ্ধতির উপর ভিত্তি করে।
সমাণুতা
সমাণুতা হলো জৈব যৌগের একটি বিশেষ বৈশিষ্ট্য। যে সকল জৈব যৌগের আণবিক সংকেত এক কিন্তু গাঠনিক সংকেত ভিন্ন তাদেরকে পরস্পরের সমাণু বলা হয়। গাঠনিক সংকেতের এই ভিন্নতার কারণে এদের ভৌত ও রাসয়নিক ধর্মেও দুই-একটি পার্থক্য দেখা যায়। জৈব যৌগের এরূপ ধর্মকে বলা হয় সমাণুতা।
সমাণুতার শ্রেণিবিভাগ
সমাণুতাকে প্রধাণত দুইটি শ্রেণিতে ভাগ করা হয়। যেমন,
► গাঠনিক সমাণুতা
► স্টেরিও বা ত্রিমাত্রিক সমাণুতা
গাঠনিক সমাণুতা
একটি যৌগের অণুতে বিদ্যমান পরমাণুসমূহের অবস্থানের ভিন্নতার কারণে যে সমাণুতার সৃষ্টি হয় তাকে গাঠনিক সমাণুতা বলে। গাঠনিক সমাণুতা ৫ প্রকার। যেমন,
⇒ শিকল বা চেইন সমাণুতা
⇒ কার্যকরী মূলক সমাণুতা
⇒ অবস্থান সমাণুতা
⇒ টটোমারিজম
⇒ মেটামারিজম
স্টেরিও বা ত্রিমাত্রিক সমাণুতা
সাধারণত একটি অণুর মধ্যে অবস্থিত পরমাণু বা গ্রুপ সমূহের একটি নিদৃষ্ট ত্রিমাত্রিক বিন্যাসকে কনফিগারেশন বলে। এই কনফিগারেশনের ভিন্নতার কারণে ত্রিমাত্রিক বা স্টেরিও সমাণুতার সৃষ্টি হয়। গ্রিক স্টেরিও শব্দের অর্থ হলো ‘ত্রিমাত্রিক স্থান’। স্টেরিও সমাণুতা দুই প্রকার,
⇒ জ্যামিতিক বা সিস-ট্রান্স সমাণুতা
⇒ আলোক সমাণুতা বা প্রতিবিম্ব সমাণুতা
নিজেকে যাচাই করার জন্য উত্তর দিয়ে দাও নিচের প্রশ্নগুলোর-
(1) সমাণুতাকে প্রধাণত কয়টি শ্রেণিতে ভাগ করা হয়?
(2) গাঠনিক সমাণুতাকে কয় ভাগে ভাগ করা যায়?
(3) স্টেরিও সমাণুতার অপর নাম কী?
(4) একটি অণুর মধ্যে অবস্থিত পরমাণু বা গ্রুপ সমূহের একটি নির্দিষ্ট ত্রিমাত্রিক বিন্যাসকে কী বলে?
5) গ্রিক স্টেরিও শব্দের অর্থ কী?
উত্তরঃ (1)দুইটি; (2)পাঁচ; (3)ত্রিমাত্রিক সমাণুতা; (4)কনফিগারেশন; (5)ত্রিমাত্রিক স্থান
শিকল বা চেইন সমাণুতা
এই সমাণুগুলো একই আণবিক সংকেতযুক্ত এবং একই সমগোত্রীয় শ্রেণির হয়ে থাকে। এদের সমাণুর কার্বন কাঠামো শাখাবিহীন এবং শাখাযুক্ত হয় এবং এর ফলে এদের ধর্মেও পার্থক্য দেখা যায়। যেমন, বিউটেন এবং 2-মিথাইল প্রোপেন উভয়েরই আণবিক সংকেত হলো C₄H₁₀ কিন্তু এদের কার্বন শিকলের গঠন ভিন্ন।

কার্যকরী মূলক সমাণুতা
যে সকল যৌগের আণবিক সংকেত এক কিন্তু তাদের কার্যকরী মূলক ভিন্ন এবং এর ফলে এদের ভৌত ও রাসয়নিক ধর্মের পার্থক্য হয়ে থাকে, তাদেরকে কার্যকরী মূলক সমাণুতা বলে। যেমন, অ্যালকোহল ও ইথার পরস্পরের কার্যকরী মূলক সমাণু। ইথানল এবং ডাই মিথাইল ইথার উভয়েরই আণবিক সংকেত C₂H₆O কিন্তু ইথানলের কার্যকরী মূলক হচ্ছে -OH এবং ডাই মিথাইল ইথারের কার্যকরী মূলক হচ্ছে R-O-R। এখনে R হলো অ্যালকাইল মূলক।

অবস্থান সমাণুতা
একই আণবিক সংকেত বিশিষ্ট একাধিক যৌগের কার্বন শিকলে একই কার্যকরী মূলকের বিভিন্ন অবস্থানের কারণে অবস্থান সমাণুতার সৃষ্টি হয়। যেমন, C₃H₈O এই আণবিক সংকেত দিয়ে দুইটি অ্যালকোহল সম্ভব ⇒ প্রপানল-1 এবং প্রপানল-2।

(কার্যকরী মূলক সমাণুতা এবং অবস্থান সমাণুতার মধ্যে একটা জিনিস মাথায় রাখতে হবে, তা হলো কার্যকরী মূলক সমাণুতে ভিন্ন কার্যকরী মূলক গঠিত হয়, কিন্তু অবস্থান সমাণুতায় একই কার্যকরী মূলকের অবস্থান ভিন্ন ভিন্ন যায়গায় হয়।)
টটোমারিজম
এই সমাণুতাটি একটু অন্যরকম। এক বিশেষ ধরণের গতিশীল কার্যকরী মূলক সমাণুতার নাম টটোমারিজম। এই প্রক্রিয়ায় সমাণুগুলোতে একটি কার্যকরী মূলক কাঠামো থেকে স্বতংস্ফূর্তভাবে ভিন্ন কার্যকরী মূলক কাঠামোতে রুপান্তরিত হয় এবং উভয় কাঠামোতে গতিশীল সাম্যবস্থা বিরাজ করে। যেমন,
প্রপানোন এর কার্যকরী মূলক হচ্ছে ‘কিটোনীয় মূলক’। প্রপানোন থেকে স্বতংস্ফূর্তভাবে প্রপিন -2-অল তৈরী হয়, অর্থাৎ কিটোন মূলক থেকে ইন ও অল মূলকে রুপান্তরিত হয়। তাই প্রপানোন এবং প্রপিন-2-অল পরস্পরের টটোমার এবং এই দুই কাঠামোর মধ্যে সাম্যবস্থা বজায় থাকে।

মেটামারিজম

উপরের উদহারণ দেখে সহজেই মেটামারিজম ব্যাপারটি বোঝা যাচ্ছে। পেন্টান – 2 – ওন এর বাম পাশে একটি এবং ডান পাশে তিনটি কার্বন রয়েছে। অপরদিকে পেন্টান – 3 – ওন এর বাম পাশে দুইটি এবং ডান পাশে দুইটি কার্বন আছে।
সব কার্যকরী মূলকের ক্ষেত্রে মেটামারিজম হয় না। দ্বিযোজী কার্যকরী মূলক যেমন, ইথার, কিটোন, সেকেন্ডারী অ্যামিন এসবের ক্ষেত্রে মেটামারিজম ঘটে। একই সমগোত্রীয় শ্রেণির মধ্যে অবস্থিত দ্বিযোজী কার্যকরী মূলকের উভয় পার্শ্বে কার্বন পরমাণু সংখ্যার ভিন্নতার কারণে যে সমাণুতার সৃষ্টি হয় তাকে মেটামারিজম বলে।
জ্যামিতিক বা সিস-ট্রান্স সমাণুতা
কোন অণুর মাঝে উপস্থিত বন্ধন যদি মুক্তভাবে ঘুরতে না পারে সেক্ষেত্রে একই আণবিক সংকেত এবং একই গাঠনিক সংকেত বিশিষ্ট দুইটি কনফিগারেশন সৃষ্টি হয়। এদেরকে পরস্পরের জ্যামিতিক সমাণু এবং এই বিষয়কে জ্যামিতিক সমাণুতা বলা হয়।
জ্যামিতিক বা সিস-ট্রান্স সমাণুতা

উপরে একটি পেঁচা দেখা যাচ্ছে, যে নিজের ইচ্ছা মতো তার মুখ ঘুরাতে পারে। মুখটিকে একটি একক বন্ধন ধরলে আমরা বলতে পারি এখানে তা মুক্তভাবে ঘুরতে পারছে। এরজন্য আমরা মুখটির কোন নিদৃষ্ট দিক পাচ্ছি না। এখন মুখটিকে আমরা যদি একটি লাঠির (এখানে লাঠিটি আরেকটি বন্ধন হিসেবে কাজ করে) সাথে বেঁধে দেই তাহলে মুখটি আর মুক্তভাবে ঘুরতে পারবে না এবং সেটি স্থির হয়ে যাবে। এর ফলে আমরা পেঁচাটির দুইটি দিক পাব, একটি মুখের সামনের দিক এবং অন্যটি মুখের পেছনের দিক। অর্থাৎ এখানে মুখের দুইটি কনফিগারেশন তৈরী হয়েছে এবং এদেরকে পরস্পরের জ্যামিতিক সমাণু বলা হয়। সুতরাং এই পুরো ব্যাপারটি দেখে আমরা বলতে পারি যে, জ্যামিতিক সমাণুতা সবার জন্য অণুতে দ্বিবন্ধন থাকতে হবে।
জ্যামিতিক সমাণুতার ব্যাখ্যা
জ্যামিতিক সমাণুতা হতে হলে অণুতে দ্বিবন্ধন থাকতে হবে। আর আমরাজানি দ্বিবন্ধন মানে হলো কার্বন পরমাণুটি SP² সংকরিত। অর্থাৎ কার্বনের একটি অরবিটাল অসংকরিত অবস্থায় থাকবে। অ্যালকিন (কার্বন-কার্বন দ্বিবন্ধন যুক্ত অণু) অণুর গঠন ব্যাখ্যা করা যাক।

C=C দ্বিবন্ধনে আবদ্ধ উভয় কার্বন পরমাণুই SP² সংকরিত এবং এরা একই সমতলে 2s, 2px, 2py সংকর অরবিটাল গঠন করে। একটি কার্বন পরমাণু তিনটি SP² সংকরিত অরবিটাল গঠন করে।

প্রত্যেকে তাদের একটি করে SP² সংকরিত অরবিটাল অধিক্রমণের মাধ্যমে নিজেদের মাঝে একটি সিগমা বন্ধন তৈরি করে। প্রতিটি কার্বন পরমাণুর অপর দুইটি SP² সংকরিত অরবিটাল অন্য কোন মূলক (a, b, c, d) এর সাথে সিগমা বন্ধন তৈরি করে। এর সবাই একই সমতলে থাকে (চিত্রের নীল রঙের অংশটি)। দুইটি কার্বন পরমাণুর ক্ষেত্রেই একটি করে 2pz অরবিটাল অসংকরিত অবস্থায় থাকে। এই দুইটি অসংকরিত 2pz অরবিটাল ওই সমতলের উপর লম্বভাবে (লাল রঙের অংশটি) অবস্থান করে এবং নিজেদের মাঝে পাশাপাশি অধিক্রমণের মাধ্যমে পাই বন্ধন তৈরি করে যা সমতলটির উপরে এবং নিচে অবস্থান করে (কমলা রঙের অংশটি)। এর ফলে উভয় কার্বন পরমাণুই দ্বিবন্ধনে আবদ্ধ হয়ে পড়ে এবং এরা নিজেদের অক্ষ বরাবর আর ঘুরতে পারে না। সহজভাবে বলতে গেলে লাঠিটি যেমন পেঁচাটির মুখকে স্থির করে ফেলেছিল এর ফলে সেটি আর তার মুখ নিজের ইচ্ছা মতো ঘুরাতে পারেনি। এই দিবন্ধনযুক্ত কার্বন পরমাণুদ্বয়ের সাথে বিভিন্ন মূলক যুক্ত হয়ে দুইটি কনফিগারেশন তৈরী করে। যেমন,
► সিস সমাণু
► ট্রান্স সমাণু
সিস সমাণু
কার্বন-কার্বন দ্বিবন্ধনের সাথে যুক্ত মূলকগুলোর মাঝে যদি দুইটি সদৃশ পরমাণু বা মূলক দ্বিবন্ধন যুক্ত কার্বনের একই দিকে অবস্থান করে তখন সেই সমাণুকে সিস সমাণু বলে।

ট্রান্স সমাণু

কার্বন-কার্বন দ্বিবন্ধনের সাথে যুক্ত মূলকগুলোর মাঝে যদি দুইটি সদৃশ পরমাণু বা মূলক দ্বিবন্ধন যুক্ত কার্বনের বিপরীত দিকে অবস্থান করে তখন সেই সমাণুকে ট্রান্স সমাণু বলে।
জ্যামিতিক সমাণুতার শর্ত
জ্যামিতিক সমাণুতার দুইটি শর্ত রয়েছে,
(১) জ্যামিতিক সমাণু হতে হলে অণুতে বন্ধনের মুক্তভাবে ঘূর্ণন বন্ধ করতে হবে। দেখা যায় যে, দুই ধরণের কাঠামোতে বন্ধনের মুক্ত ঘূর্ণন সম্ভব নয়, তা হলো-
► দ্বিবন্ধনযুক্ত যৌগ
► চাক্রিক যৌগ

উপরের চিত্রে যে যৌগটি রয়েছে তাতে বন্ধনের মুক্ত আবর্তন হচ্ছে। সুতরাং এইক্ষেত্রে জ্যামিতিক সমাণুতা সম্ভব নয়।
(২) দ্বিবন্ধনযুক্ত কার্বনের সাথে অন্য যে মূলকগুলো যুক্ত থাকে তারা পরস্পর থেকে ভিন্ন হতে হবে। অর্থাৎ a, b, c, d চারটি মূলকই এক হতে পারবে না।
দ্বিবন্ধনযুক্ত যৌগ
আসো কিছু উদহারণের মাধ্যমে দ্বিবন্ধনযুক্ত যৌগের জ্যামিতিক কাঠামো দেখে নিয়া যাক,
চাক্রিক যৌগ

সাধারণত একটি মুক্ত শিকলের দুই প্রান্ত যুক্ত হয়ে চাক্রিক যৌগ গঠন করে। চাক্রিক যৌগের ক্ষেত্রে বন্ধনের মুক্ত আবর্তন সম্ভব নয়, সুতরাং এটিও জ্যামিতিক সমাণুতা দেখাতে পারবে। চাক্রিক যৌগের ত্রিমাত্রিক কাঠামোতে যখন সদৃশ মূলকগুলো একই দিকে থাকে তখন তা হলো সিস সমাণু এবং যখন বিপরীত দিকে থাকে তখন তা হলো ট্রান্স সমাণু।
এখানে তিনটি কার্বন বদ্ধ অবস্থায় আছে তাই এটা হবে সাইক্লোপ্রপেন। যেহেতু 1 নাম্বার এবং 2 নাম্বার কার্বনে দুইটি মিথাইল (-CH₃) মূলক আছে তাই ডাইমিথাইল হয়ছে। যখন মিথাইল দুইটি একই দিকে অবস্থিত তখন নামকরণে সিস হয়েছে এবং যখন মিথাইল মূলক দুইটি বিপরীত দিকে অবস্থিত তখন নামকরণে ট্রান্স হয়েছে।
জ্যামিতিক সমাণুতা একটি জ্যামিতিক বৈশিষ্ট্য, যেখানে একটি বস্তু নির্দিষ্ট নিয়ম বা প্রক্রিয়ার মাধ্যমে অপরিবর্তিত থাকে। এটি গণিত, পদার্থবিজ্ঞান, এবং প্রকৌশলের বিভিন্ন ক্ষেত্রে গুরুত্বপূর্ণ। জ্যামিতিক সমাণুতা সাধারণত প্রতিসাম্যতা (symmetry) নামে পরিচিত এবং বিভিন্ন ধরনের রূপ ধারণ করে।
১. অক্ষীয় প্রতিসাম্য (Axial Symmetry):
যদি কোনো বস্তু একটি নির্দিষ্ট অক্ষ বরাবর ঘুরানোর পরেও একই থাকে, তবে সেটি অক্ষীয় প্রতিসাম্য ধারণ করে।
উদাহরণ: গোলকের প্রতিসাম্য।
২. পরিবর্তন প্রতিসাম্য (Translational Symmetry):
একটি বস্তুকে নির্দিষ্ট দূরত্বে স্থানান্তর করলে যদি সেটির গঠন অপরিবর্তিত থাকে, তবে সেটি পরিবর্তন প্রতিসাম্য ধারণ করে।
উদাহরণ: টাইলের নকশা।
৩. ঘূর্ণন প্রতিসাম্য (Rotational Symmetry):
যদি একটি বস্তুকে একটি নির্দিষ্ট কোণে ঘুরানোর পরেও সেটি একই থাকে, তবে সেটি ঘূর্ণন প্রতিসাম্য ধারণ করে।
উদাহরণ: ত্রিভুজের ঘূর্ণন প্রতিসাম্য।
৪. প্রতিফলন প্রতিসাম্য (Reflection Symmetry):
একটি বস্তুর যদি কোনো নির্দিষ্ট অক্ষের দুই পাশে সমানভাবে প্রতিবিম্বিত হয়, তবে সেটি প্রতিফলন প্রতিসাম্য ধারণ করে।
উদাহরণ: প্রজাপতির ডানার সমানুপাতিক গঠন।
জ্যামিতিক সমাণুতা প্রকৃতির বিভিন্ন ক্ষেত্রে পাওয়া যায় এবং এটি নকশা, স্থাপত্য, এবং প্রাকৃতিক বিজ্ঞানে ব্যবহৃত হয়।
উদাহরণ: ক্রিস্টাল স্ট্রাকচার, প্রাণীর শরীরের গঠন।
জ্যামিতিক সমাণুতার ধারণা
জ্যামিতিক সমাণুতা (Geometric Symmetry) হলো একটি জ্যামিতিক আকার বা বস্তুর এমন গুণ, যেখানে নির্দিষ্ট নিয়ম বা ক্রিয়ার মাধ্যমে তা নিজেকে অপরিবর্তিত রাখে। এটি কোনো আকার বা বস্তুতে সামঞ্জস্য এবং সৌন্দর্যের অন্যতম প্রধান বৈশিষ্ট্য।
জ্যামিতিক সমাণুতার প্রকারভেদ
১. ঘূর্ণন সমাণুতা (Rotational Symmetry):
যদি একটি জ্যামিতিক আকার নির্দিষ্ট বিন্দুর চারপাশে একটি নির্দিষ্ট কোণে ঘূর্ণিত হয়ে তার মূল অবস্থানের মতোই দেখায়, তবে সেটিকে ঘূর্ণন সমাণুতা বলে।
২. আয়নার প্রতিবিম্ব সমাণুতা (Reflectional Symmetry):
যদি কোনো জ্যামিতিক আকার একটি রেখার (Line of Symmetry) মাধ্যমে দুই সমান ভাগে বিভক্ত হয় এবং এক অংশ অপর অংশের আয়নার প্রতিবিম্ব হয়, তবে সেটিকে আয়নার প্রতিবিম্ব সমাণুতা বলে।
৩. অনুবর্তন সমাণুতা (Translational Symmetry):
যদি একটি জ্যামিতিক আকার নির্দিষ্ট দূরত্বে এবং নির্দিষ্ট দিকে সরানো হলে তার আকৃতি অপরিবর্তিত থাকে, তবে সেটিকে অনুবর্তন সমাণুতা বলে।
৪. ঘূর্ণায়মান আয়নার প্রতিবিম্ব সমাণুতা (Glide Reflection Symmetry):
যদি একটি জ্যামিতিক আকার ঘূর্ণনের পাশাপাশি আয়নার প্রতিবিম্ব প্রদর্শন করে, তবে সেটি এই ধরনের সমাণুতা প্রদর্শন করে।
জ্যামিতিক সমাণুতার ব্যবহার
আলোক সক্রিয় সমাণুতা কী?
আলোক সক্রিয় সমাণুতা হল এমন সমাণু গঠনের বৈশিষ্ট্য যেখানে অণুগুলি একে অপরের আয়নীয় চিত্রের মতো হয় কিন্তু একে অপরের উপর আরোপণযোগ্য নয়। এর ফলে, এই অণুগুলি প্লেন-পোলারাইজড আলোকে ভিন্ন ভিন্ন দিকে ঘুরিয়ে দেয়।
শর্তাবলী:
উদাহরণ:
গুরুত্ব:
আলোক সক্রিয়তা (Optical Activity) একটি পদার্থের বৈশিষ্ট্য, যার মাধ্যমে এটি সমতল পোলারাইজড আলোকে একটি নির্দিষ্ট কোণে ঘুরিয়ে দিতে সক্ষম হয়। এই বৈশিষ্ট্যবিশিষ্ট পদার্থগুলিকে বলা হয় আলোক সক্রিয় পদার্থ।
সমতল পোলারাইজড আলো যখন আলোক সক্রিয় পদার্থের মধ্যে দিয়ে প্রবাহিত হয়, তখন এটি একটি নির্দিষ্ট কোণে ঘুরে যায়। এই কোণটিকে ঘূর্ণন কোণ (Angle of Rotation) বলা হয়।
আলোক সক্রিয়তা একটি বিশেষ বৈশিষ্ট্য, যা রাসায়নিক এবং জৈবিক প্রক্রিয়াগুলিতে গুরুত্বপূর্ণ ভূমিকা পালন করে। এটি পোলারাইজড আলোর ঘূর্ণনের মাধ্যমে পদার্থের চিরাল প্রকৃতি সনাক্ত করতে সাহায্য করে।
আলোক সক্রিয় সমাণুর এই ধর্ম তাদের রাসায়নিক, জৈবিক, এবং ঔষধি ব্যবহারে গুরুত্বপূর্ণ ভূমিকা পালন করে।
অপ্রতিসম কার্বন পরমাণু হলো এমন একটি কার্বন পরমাণু যা চারটি ভিন্ন পরমাণু বা পরমাণু গোষ্ঠীর সাথে যুক্ত থাকে। এই ধরনের কার্বন পরমাণুর উপস্থিতি একটি যৌগের অণুতে আলোক সমাণুর উৎপত্তি ঘটায়।
যদি কোনো অণুতে \( n \) সংখ্যক অপ্রতিসম কার্বন পরমাণু থাকে, তবে ঐ অণুটির আলোক সমাণুর সংখ্যা \( 2^n \)। প্রতিটি অপ্রতিসম কার্বন দুটি ভিন্ন ভৌত বিন্যাস সৃষ্টি করতে পারে, যা একে অপরের প্রতিচ্ছবি।
যদি একটি যৌগ মেশো গঠন প্রদর্শন করে, তবে তার আলোক সমাণুর সংখ্যা কমে যেতে পারে। মেশো গঠন হচ্ছে এমন একধরনের গঠন যেখানে অভ্যন্তরীণ প্রতিসমতার কারণে কিছু আলোক সমাণু অস্তিত্ব হারায়।
অপ্রতিসম কার্বনের সংখ্যার উপর ভিত্তি করে আলোক সমাণুর সংখ্যা \( 2^n \) সূত্র দ্বারা নির্ধারণ করা হয়। তবে মেশো যৌগের ক্ষেত্রে এই সংখ্যা কমে যেতে পারে।
গাঠনিক সমাণু বলতে এমন যৌগকে বোঝায় যা একই সংকেত অনুসরণ করে কিন্তু গঠনগতভাবে আলাদা। গাঠনিক সমাণু নির্ণয়ের জন্য মৌলিক ধারণাগুলো জানা প্রয়োজন:
জৈব যৌগের সংকেতের রাসায়নিক সূত্র থেকে সব সম্ভাব্য গাঠনিক সমাণু বের করতে হবে।
মূল কাঠামো গঠন করতে হলে:
মূল কাঠামো ধরে বিভিন্ন স্থানে সংযোজন, বন্ধন, এবং শৃঙ্খল বিভাজনের মাধ্যমে গঠনের বিভিন্ন রূপ তৈরি করতে হবে।
প্রতিটি গঠন অনুযায়ী আইইউপিএসি (IUPAC) নামকরণ নিশ্চিত করতে হবে যাতে প্রতিটি গঠনের ভিন্নতা বোঝা যায়।
সব গঠন পর্যালোচনা করে সমাণু সংখ্যা নির্ধারণ করতে হবে।
C₄H₁₀ সংকেতের গাঠনিক সমাণু:
এখানে গাঠনিক সমাণুর সংখ্যা হলো ২।
গাঠনিক সমাণু নির্ণয়ের সময় মনোযোগ দিতে হবে:
জৈব যৌগের সংকেত থেকে গাঠনিক সমাণু নির্ণয়ের জন্য সংকেত বিশ্লেষণ, কাঠামো গঠন, এবং আইইউপিএসি পদ্ধতি অনুসরণ করতে হয়। গঠনের প্রতিটি ভিন্নতার মাধ্যমে গঠিত সমাণু সংখ্যা নির্ণয় করা সম্ভব।
অ্যারোমেটিক শব্দটি গ্রিক শব্দ অ্যারোমা (Aroma) থেকে এসেছে। অ্যারোমেটিক নামকরনের পেছনে একটি কারণ রয়েছে। বিজ্ঞানীরা প্রথম যে অ্যারোমেটিক যৌগগুলো খুঁজে পেয়েছিলেন সেগুলো ছিল সুগন্ধিযুক্ত। আর সুগন্ধিযুক্ত কে ইংরেজিতে বলে aromatic বা aroma। আর তাই ঐ যৌগগুলোর গাঠনিক সংকেত এর মতো গাঠনিক সংকেত বিশিষ্ট সকল যৌগগুলোর নামই অ্যারোমেটিক রাখা হয়। অ্যারোমেটিক যৌগগুলোর মধ্যে সবচেয়ে পরিচিত হলো বেনজিন(C6H6), ন্যাপথ্যালিন(C10H8)এবং অ্যানথ্রাসিন(C14H10)^।অ্যারোমেটিক যৌগগুলো সাধারণত 5, 6 অথবা 7 সদস্যের সমতলীয় যৌগ। অর্থাৎ হাইড্রোকার্বন গুলোকে একটি সুষম পঞ্চভূজ,ষড়ভুজ অথবা সপ্তভূজ দিয়ে গাঠনিক বন্ধন বোঝানো হয়। এ যৌগগুলোতে একান্তর দ্বিবন্ধন থাকে।অর্থাৎ একটি একক বন্ধনের পরে একটি দ্বিবন্ধন থাকে। অ্যারোমেটিক যৌগে কখনো ত্রিবন্ধন ব্যবহৃত হয় না।সকল অ্যারোমাটিক যৌগগুলোকে হাকেল নীতি অনুসারে (4n+2) সংখ্যক সঞ্চারণশীল পাই ইলেক্ট্রন যৌগ দ্বারা চিহ্নিত করা যায়।এছাড়া কিছু ব্যতিক্রম ছাড়া সকল অ্যারোমাটিক যৌগগুলোকে এদের সাধারণ সঙ্কেত দ্বারা প্রকাশ করা যায়।সেটি হলো (C4r+2H2r+4) যেখানে r=বলয় সংখ্যা।
জৈব যৌগের একটা গুরুত্বপূর্ণ টপিক হচ্ছে লঘু তেল থেকে কীভাবে বেনজিন এবং টলুইন পৃথক করা যায়?প্রথমে আলকাতরাকে ১৭০ ডিগ্রি সেলসিয়াস তাপমাত্রায় আংশিক পাতন করলে লঘু তেল পাওয়া যায় ।লঘু তেলের মধ্যে তিন ধরণের রাসায়নিক পদার্থ পাওয়া যায়।অম্লীয় উপাদান হিসেবে ফেনল,ক্ষারীয় উপাদান হিসেবে আ্যনিলিন,পিরিডিন ও থায়োফিন এবং নিরপেক্ষ উপাদান হিসেবে বেনজিন,টলুইন এবং জাইলিন পাওয়া যায়।যেহেতু এখান থেকে আমরা টলুইন এবং বেনজিনকে পৃথক করব তাই অপর উপাদানগুলোকে বাদ দিতে হবে।বাদ দেওয়ার জন্য প্রথমে কিছু রাসায়নিক বিক্রিয়া সংগঠিত হয়।অম্লীয় উপাদানকে বাদ দেওয়ার জন্য অর্থ্যাৎ ফেনলের সাথে ১০% সোডিয়াম হাইড্রক্সাইড বিক্রিয়ার মাধ্যমে সোডিয়াম ফিনেট প্রস্তুত করা হয়,অপরদিকে ক্ষারীয় উপাদানকে বাদ দেওয়ার জন্য আ্যনিলিনকে সালফিউরিক এসিড দ্বারা বিক্রিয়া করলে আ্যনিলিন সালফেট (লবণ )উৎপন্ন হয়।প্রাপ্ত লঘু তেলকে ৭০-১১০ ডিগ্রি সেলসিয়াস তাপমাত্রায় আংশিক পাতন করলে ৯০% বেনজল উৎপন্ন হয়।যেহেতু বেনজলের মধ্যে ৮৪% বেনজিন,১৩% টলুইন এবং ৩% জাইলিন পাওয়া যায়।তাই বেনজলকে ৮০-৮২% তাপমাত্রায় আংশিক পাতন করলে ৯৯% বিশুদ্ধ বেনজিন পাওয়া যায়।প্রাপ্ত ৯০% বেনজলকে ৫০% বেনজলের সাথে মিশ্রিত করলে বিশুদ্ধ টলুইন পাওয়া যায়।
বেনজিন একটি অ্যারোমেটিক যৌগ যার আণবিক গঠন অত্যন্ত স্থিতিশীল এবং এর বিশেষ বৈশিষ্ট্যের জন্য এটি কেমিস্ট্রির জগতে গুরুত্বপূর্ণ। বেনজিনের আণবিক অরবিটাল গঠন তার স্থিতিশীলতা এবং অ্যারোমেটিসিটির মূল ভিত্তি।
বেনজিনের প্রতিটি কার্বন পরমাণু sp² হাইব্রিডাইজড। প্রতিটি কার্বনের তিনটি sp² হাইব্রিড অরবিটাল থেকে দুটি অরবিটাল প্রতিবেশী কার্বনের সাথে σ (সিগমা) বন্ধন তৈরি করে এবং তৃতীয় অরবিটাল একটি হাইড্রোজেন পরমাণুর সাথে সংযুক্ত হয়। এইভাবে, বেনজিনের ছয়টি কার্বন একটি ষড়ভুজাকার রিং গঠন করে।
sp² হাইব্রিডাইজেশনের পর প্রতিটি কার্বনের একটি অপরিবর্তিত p-অরবিটাল থাকে। এই p-অরবিটালগুলো রিংয়ের সমতল থেকে উপরে এবং নিচে অবস্থিত। বেনজিনে এই p-অরবিটালগুলো একে অপরের সাথে অভিসারি হয়ে একটি π-ইলেকট্রন মেঘ তৈরি করে। এই মেঘ রিংয়ের উপর এবং নিচে ডেলোকালাইজড অবস্থায় থাকে, যা বেনজিনের স্থিতিশীলতার মূল কারণ।
বেনজিনের আণবিক অরবিটাল গঠন রেজোন্যান্স দ্বারা সমর্থিত। এই রেজোন্যান্স প্রক্রিয়ার মাধ্যমে π-ইলেকট্রনগুলো ছয়টি কার্বনের মধ্যে সমানভাবে ছড়িয়ে পড়ে, যা বেনজিনকে অত্যন্ত স্থিতিশীল করে তোলে। এ কারণেই বেনজিন সাধারণত সহজে প্রতিস্থাপন বিক্রিয়া (substitution reactions) করে, তবে সংযোজন বিক্রিয়া (addition reactions) এড়িয়ে চলে।
বেনজিনের ডেলোকালাইজড π-ইলেকট্রন ব্যবস্থা এটি অ্যারোমেটিক বৈশিষ্ট্য প্রদান করে। অ্যারোমেটিক যৌগগুলোর মতো বেনজিনও হাকেলের নিয়ম (Hückel's Rule) মেনে চলে, যেখানে π-ইলেকট্রনের সংখ্যা 4n+2 সূত্রের সাথে সামঞ্জস্যপূর্ণ (n = 1 হলে π-ইলেকট্রন সংখ্যা 6)।
বেনজিনের আণবিক অরবিটাল গঠন তার স্থিতিশীলতা এবং অ্যারোমেটিক বৈশিষ্ট্যের মূল কারণ। sp² হাইব্রিডাইজেশন, π-অরবিটালের ডেলোকালাইজেশন এবং রেজোন্যান্স প্রক্রিয়া বেনজিনকে একটি বিশেষ বৈশিষ্ট্যপূর্ণ যৌগ হিসেবে প্রতিষ্ঠিত করেছে, যা জৈব রসায়নে গুরুত্বপূর্ণ ভূমিকা পালন করে।
অ্যারোমেটিক শব্দটি গ্রিক শব্দ অ্যারোমা (Aroma) থেকে এসেছে। অ্যারোমেটিক নামকরনের পেছনে একটি কারণ রয়েছে। বিজ্ঞানীরা প্রথম যে অ্যারোমেটিক যৌগগুলো খুঁজে পেয়েছিলেন সেগুলো ছিল সুগন্ধিযুক্ত। আর সুগন্ধিযুক্ত কে ইংরেজিতে বলে aromatic বা aroma। আর তাই ঐ যৌগগুলোর গাঠনিক সংকেত এর মতো গাঠনিক সংকেত বিশিষ্ট সকল যৌগগুলোর নামই অ্যারোমেটিক রাখা হয়। অ্যারোমেটিক যৌগগুলোর মধ্যে সবচেয়ে পরিচিত হলো বেনজিন(C6H6), ন্যাপথ্যালিন(C10H8)এবং অ্যানথ্রাসিন(C14H10)^১।অ্যারোমেটিক যৌগগুলো সাধারণত 5, 6 অথবা 7 সদস্যের সমতলীয় যৌগ। অর্থাৎ হাইড্রোকার্বন গুলোকে একটি সুষম পঞ্চভূজ,ষড়ভুজ অথবা সপ্তভূজ দিয়ে গাঠনিক বন্ধন বোঝানো হয়। এ যৌগগুলোতে একান্তর দ্বিবন্ধন থাকে।অর্থাৎ একটি একক বন্ধনের পরে একটি দ্বিবন্ধন থাকে। অ্যারোমেটিক যৌগে কখনো ত্রিবন্ধন ব্যবহৃত হয় না।সকল অ্যারোমাটিক যৌগগুলোকে হাকেল নীতি অনুসারে (4n+2) সংখ্যক সঞ্চারণশীল পাই ইলেক্ট্রন যৌগ দ্বারা চিহ্নিত করা যায়।এছাড়া কিছু ব্যতিক্রম ছাড়া সকল অ্যারোমাটিক যৌগগুলোকে এদের সাধারণ সঙ্কেত দ্বারা প্রকাশ করা যায়।সেটি হলো (C4r+2H2r+4) যেখানে r=বলয় সংখ্যা।
যেসব যৌগের আনবিক সংকেত বা গঠনে (4n +2) সংখ্যক পাই (π) ইলেকট্রন অনবরত সঞ্চরনশীল অসম্পৃক্ত অবস্থায় থাকে, সেসব যৌগ সমূহকে অ্যারোমেটিক যৌগ বলে। অ্যারোমেটিক যৌগের বিশেষ ধর্মকে অ্যারোমেটিসিটি বলা হয়।
উদাহারনঃ ন্যাফথ্যালিন (C10H8), পাইরোল (C4H4NH) , ফিউরান (C4H4O), থায়োফিন (C4H4S) ইত্যাদি জৈব যৌগ সমূহ হচ্ছে অ্যারোমেটিক যৌগের উদাহারন। প্রথম বন্ধনীর ভিতরে যৌগের সংকেত দেওয়া হয়েছে।
যেসব যৌগ হাকেল নীতি মেনে চলে তারাই অ্যারোমেটিক যৌগ। হাকেল নীতি অনুসারে যেসব যৌগে (4n +2) সংখ্যক পাই (π) ইলেকট্রন অনুরণন অবস্থায় থাকবে, সেসব যৌগ সমূহকে অ্যারোমেটিক যৌগ বলা যাবে। অর্থাৎ, হাকেল নীতি প্রয়োগ করে অ্যারোমেটিক যৌগ চেনা যাবে। যেমন, ন্যাফথ্যালিন (C10H8) জৈব যৌগটি একটি অ্যারোমেটিক যৌগ। কারন, ন্যাফথ্যালিনে (4n +2) সংখ্যক পাই (π) ইলেকট্রন আছে। এখানে, n হচ্ছে কোনো একটি জৈব যৌগে বেনজিন বলয়ের সংখ্যা। নিচের ছবিতে ন্যাফথ্যালিনের গাঠনিক সংকেত দেখানো হল। ন্যাফথ্যালিনে ৫ টি দ্বিবন্ধনে মোট ১০ টি পাই ইলেকট্রন ও ২ টি বেনজিন বলয় রয়েছে। তাহলে, হাকেল নীতি অনুসারে n=2, (4x2 + 2) = 10, অর্থাৎ ১০ টি পাই ইলেকট্রন ন্যাফথ্যালিনে আছে। অতএব, ন্যাফথ্যালিন একটি অ্যারোমেটিক যৌগ, যা হাকেল নীতি অনুসারে প্রমানিত।
অ্যালিফেটিক যৌগঃ
অ্যালিফেটিক শব্দটির অর্থ চর্বিজাত। গ্রিক শব্দ ‘অ্যালিফার’ অর্থাৎ চর্বি থেকে এটি এসেছে। চর্বিজাত হউক বা না হউক সকল মুক্ত শিকল হাইড্রোকার্বন ও সম্পৃক্ত চাক্রিক হাইড্রোকার্বন এবং তাদের জাতককে অ্যালিফেটিক যৌগ বলে। অথাৎ যে সব জৈব যৌগের অণুতে কার্বন পরমাণুসমূহের মুক্ত শিকল বিদ্যমান তাদের অ্যালিফেটিক যৌগ বলা হয়। যেমন: CH3-CH3 (ইথেন), CH3-CH2-OH (ইথানল), সাইক্লোপ্রপেন ইত্যাদি। গঠনের উপর ভিত্তি করে অ্যালিফেটিক যৌগসমূহকে আবার দু’ভাগে ভাগ করা যায়। যথা:
ক. মুক্ত শিকল অ্যালিফেটিক যৌগ ও
খ. বদ্ধ শিকল বা চাত্রিক অ্যালিফেটিক যৌগ।
অ্যালিফ্যাটিক যৌগগুলি কার্বন-কার্বন একক বন্ধনের মাধ্যমে যুক্ত হয়ে সম্পৃক্ত যৌগ (অ্যালকেন) অথবা কার্বন-কার্বন দ্বি-বন্ধনের মাধ্যমে যুক্ত হয়ে অসম্পৃক্ত যৌগ গঠন করে। হাইড্রোজেন ছাড়াও অন্যান্য মৌলও কার্বন শৃঙ্খলে আবদ্ধ হতে পারে। সাধারণত অক্সিজেন, নাইট্রোজেন, সালফার এবং ক্লোরিনই সবচেয়ে বেশি যুক্ত হয়। সর্বনিম্ন জটিল অ্যালিফ্যাটিক যৌগটি হল মিথেন (CH4)।
অ্যারোমেটিক যৌগ:
যে সব চাক্রিক বা হেটারোচাক্রিক যৌগে (4n+2) সংখ্যক সঞ্চারণশীল পাই (π) ইলেকট্রন থাকে, তাদেরকে অ্যারোমেটিক যৌগ বলে। 4n+2 সূত্রে n= 123 হলে সঞ্চারণশীল পাই ইলেকট্রন দাড়ায় যথাক্রমে 6, 10, 14। বেনজিন, ফেনল ও টলুইনে 6টি করে সঞ্চারণশীল পাই ইলেকট্রন থাকে। ন্যাপথালিন যৌগ 10টি পাই ইলেকট্রন থাকে। তাই এরা সবাই অ্যারোমেটিক যৌগ।
অ্যারোমেটিক যৌগগুলোর মধ্যে সবচেয়ে পরিচিত হলো বেনজিন(C6H6), ন্যাপথ্যালিন(C10H8)এবং অ্যানথ্রাসিন(C14H10)^১। অ্যারোমেটিক যৌগগুলো সাধারণত 5, 6 অথবা 7 সদস্যের সমতলীয় যৌগ। অর্থাৎ হাইড্রোকার্বন গুলোকে একটি সুষম পঞ্চভূজ,ষড়ভুজ অথবা সপ্তভূজ দিয়ে গাঠনিক বন্ধন বোঝানো হয়। অ্যারোমেটিক যৌগে কখনো ত্রিবন্ধন ব্যবহৃত হয় না।
অ্যালিফেটিক ও অ্যারোমেটিক যৌগের মধ্যে পার্থক্য:
যে সব জৈব যৌগের অণুতে কার্বন পরমাণুসমূহের মুক্ত শিকল বিদ্যমান তাদের অ্যালিফেটিক যৌগ বলা হয়। অ্যালিফেটিক ও অ্যারোমেটিক যৌগের মধ্যে পার্থক্য নিম্নরূপ-
১. অ্যালিফেটিক যৌগ প্রধানত মুক্ত শিকলবিশিষ্ট। অন্যদিকে অ্যারোমেটিক যৌগসমূহ চাক্রিক বা বলয় আকৃতির হয়।
২. অ্যালিফেটিক যৌগ সম্পৃক্ত বা অসম্পৃক্ত হতে পারে। অন্যদিকে সকল অ্যারোমেটিক যৌগ অসমম্পৃক্ত।
৩. অ্যালিফেটিক যৌগে কার্বনের পরিমাণ কম থাকে। অন্যদিকে অ্যারোমেটিক যৌগে কার্বনের পরিমাণ বেশি থাকে।
৪. অ্যালিফেটিক যৌগে প্রতিস্থাপন বিক্রিয়া সহজে সংঘটিত হয় না। অন্যদিকে অ্যারোমেটিক যৌগে সহজেই প্রতিস্থাপন বিক্রিয়া ঘটে।
৫. অ্যালিফেটিক হ্যালাইড অত্যন্ত সক্রিয়। অন্যদিকে অ্যারোমেটিক হ্যালাইড তুলনামূলকভাবে কম সক্রিয়।
৬. অ্যালিফেটিক হাইড্রক্সি যৌগ নিরপেক্ষ। অন্যদিকে অ্যারোমেটিক হাইড্রক্সি যৌগ অম্লীয়।
অ্যালিফেটিক যৌগে সাধারণত ডাবল বা ট্রিপল বন্ধনযুক্ত কার্বনের সাথে সংযোজন বিক্রিয়া ঘটে। উদাহরণস্বরূপ:
হাইড্রোজেনেশন (Hydrogenation): ডাবল বা ট্রিপল বন্ধনযুক্ত অ্যালিফেটিক যৌগে হাইড্রোজেন যোগ করে সম্পৃক্ত যৌগে রূপান্তরিত করা।
উদাহরণ:
\[ C_2H_4 + H_2 → C_2H_6 \]
পরিবর্তনশীল অবস্থায় অ্যালিফেটিক যৌগে এক বা একাধিক হাইড্রোজেন পরমাণুর জায়গায় অন্য মৌল প্রতিস্থাপিত হয়।
উদাহরণ:
\[ CH_4 + Cl_2 → CH_3Cl + HCl \]
অ্যালিফেটিক যৌগে জারণের মাধ্যমে কার্বক্সিলিক অ্যাসিড বা অ্যালকোহল তৈরি হতে পারে।
উদাহরণ:
\[ CH_3CH_2OH + [O] → CH_3COOH \]
অ্যারোমেটিক যৌগের সবচেয়ে সাধারণ বিক্রিয়া। এই বিক্রিয়ায় আরোমাটিক রিংয়ে একটি হাইড্রোজেন প্রতিস্থাপিত হয়। উদাহরণস্বরূপ:
অ্যারোমেটিক যৌগে বিশেষ অবস্থায় ডাবল বন্ধনযুক্ত রিংয়ে সংযোজন বিক্রিয়া ঘটে।
উদাহরণ:
\[ C_6H_6 + H_2 → C_6H_{12} \]
অ্যারোমেটিক যৌগে জারণের মাধ্যমে সাইড চেইনে কার্বক্সিলিক অ্যাসিড তৈরি হয়।
উদাহরণ:
\[ C_6H_5CH_3 + [O] → C_6H_5COOH \]
এই আলোচনায় অ্যালিফেটিক ও অ্যারোমেটিক যৌগে সংযোজন, প্রতিস্থাপন এবং জারণ-বিজারণ বিক্রিয়াসমূহের বিভিন্ন প্রক্রিয়া তুলে ধরা হয়েছে।
এই বিক্রিয়া জৈব রসায়নের একটি গুরুত্বপূর্ণ ধাপ।
প্রতিস্থাপন বিক্রিয়া এমন একটি রাসায়নিক বিক্রিয়া, যেখানে একটি যৌগের একটি পরমাণু বা পরমাণু গোষ্ঠী অন্য একটি পরমাণু বা পরমাণু গোষ্ঠী দ্বারা প্রতিস্থাপিত হয়। এ ধরনের বিক্রিয়া সাধারণত জৈব এবং অজৈব উভয় রসায়নে ঘটে।
প্রতিস্থাপন বিক্রিয়া একটি মৌলিক রাসায়নিক প্রক্রিয়া যা পদার্থের গঠন পরিবর্তন করে নতুন পদার্থ সৃষ্টি করে। এটি একক ও যুগ্ম প্রতিস্থাপন এবং জৈব রসায়নে নিউক্লিওফিলিক ও ইলেক্ট্রোফিলিক প্রক্রিয়ায় বিভক্ত।
অপসারণ বিক্রিয়া (Elimination Reaction) হলো এমন এক প্রকার জৈব রাসায়নিক বিক্রিয়া, যেখানে একটি যৌগ থেকে দুটি পরমাণু বা গোষ্ঠী অপসারিত হয়ে নতুন একটি যৌগ গঠিত হয়। এটি সাধারণত অ্যালকেন, অ্যালকাইন, বা চক্রাকার যৌগ তৈরি করতে ব্যবহৃত হয়।
E1 বিক্রিয়া উদাহরণ:
অ্যালকোহল থেকে অ্যালকেন তৈরি:
\[ CH_3CH_2OH \xrightarrow{H_2SO_4} CH_2=CH_2 + H_2O \]
E2 বিক্রিয়া উদাহরণ:
হ্যালোআলকেন থেকে অ্যালকেন তৈরি:
\[ CH_3CH_2Br + NaOH \rightarrow CH_2=CH_2 + H_2O + NaBr \]
১. বেসের শক্তি: শক্তিশালী বেস অপসারণ বিক্রিয়াকে ত্বরান্বিত করে।
২. তাপমাত্রা: উচ্চ তাপমাত্রায় বিক্রিয়া বেশি কার্যকর।
৩. লিভিং গ্রুপের প্রকৃতি: দুর্বল বেসিক লিভিং গ্রুপ ভালো ফল দেয়।
অপসারণ বিক্রিয়ার মাধ্যমে জৈব যৌগের নতুন গঠন এবং বন্ধন সৃষ্টি করা সম্ভব, যা জৈব রসায়নে গুরুত্বপূর্ণ ভূমিকা পালন করে।
পারমাণবিক পুনর্বিন্যাস (Atomic Rearrangement) বা সমাণুকরণ একটি প্রক্রিয়া যেখানে পরমাণুগুলোর অবস্থান পরিবর্তিত হয়, তবে পরমাণুর সংখ্যা এবং ধরণ অপরিবর্তিত থাকে। এটি রাসায়নিক বিক্রিয়ার একটি গুরুত্বপূর্ণ ধাপ, যা বিভিন্ন রাসায়নিক যৌগের গঠন পরিবর্তনের জন্য প্রয়োজন।
পারমাণবিক পুনর্বিন্যাসে পরমাণুগুলোর অবস্থান এবং রাসায়নিক বন্ধনের প্রকৃতি পরিবর্তিত হয়। তবে এ প্রক্রিয়ায় মোট পরমাণুর সংখ্যা এবং যৌগটির রাসায়নিক গঠন অপরিবর্তিত থাকে। উদাহরণস্বরূপ, জৈব যৌগে কার্বন এবং হাইড্রোজেন পরমাণুসমূহের অবস্থান পরিবর্তনের মাধ্যমে নতুন যৌগ তৈরি হয়।
১. ইসোমারাইজেশন (Isomerization):
ইসোমারাইজেশনে একটি যৌগের পরমাণুগুলো পুনর্বিন্যাসিত হয়ে একই রাসায়নিক সূত্রযুক্ত ভিন্ন গঠন বা ইসোমার তৈরি করে। উদাহরণ: বাটেন (Butene) এর গঠনগত ইসোমার।
২. পরিবর্তনশীল পুনর্বিন্যাস (Dynamic Rearrangement):
এটি এমন একটি প্রক্রিয়া যেখানে যৌগটি রাসায়নিক বিক্রিয়ার মাধ্যমে পুনর্বিন্যাসিত হয় এবং এর স্থায়িত্ব বাড়ে। উদাহরণ: কার্বোক্যাটিয়নগুলোর পুনর্বিন্যাস।
১. গঠনের পরিবর্তন:
পুনর্বিন্যাসের মাধ্যমে নতুন ইসোমার তৈরি হয়, যা বৈশিষ্ট্যে ভিন্ন।
২. পুনর্বিন্যাসিত যৌগের স্থিতিশীলতা:
পুনর্বিন্যাসিত যৌগ সাধারণত পূর্বের যৌগের চেয়ে বেশি স্থিতিশীল হয়।
৩. বিক্রিয়ার গতি এবং দিকনির্দেশনা:
পুনর্বিন্যাস রাসায়নিক বিক্রিয়ার গতিকে প্রভাবিত করে এবং বিক্রিয়ার চূড়ান্ত পণ্য নির্ধারণে গুরুত্বপূর্ণ ভূমিকা পালন করে।
পারমাণবিক পুনর্বিন্যাস বা সমাণুকরণ রাসায়নিক বিক্রিয়ার একটি গুরুত্বপূর্ণ উপাদান, যা বিভিন্ন প্রক্রিয়ার মাধ্যমে যৌগের গঠন, বৈশিষ্ট্য এবং স্থিতিশীলতা পরিবর্তন করে।











অ্যালকেন প্রস্তুতির একটি সাধারণ পদ্ধতি। হ্যালোজেনযুক্ত অ্যালকেন থেকে হাইড্রোজেন এবং হ্যালোজেন পরমাণু অপসারণ করে অ্যালকেন তৈরি করা হয়।
প্রতিক্রিয়া:
\[ CH_3CH_2Br + alc.KOH → CH_2=CH_2 + HBr \]
(ইথান থেকে ইথিন প্রস্তুতি)
অ্যালকোহলকে জারণের মাধ্যমে পানির অণু অপসারণ করে অ্যালকেন তৈরি করা হয়।
প্রতিক্রিয়া:
\[ CH_3CH_2OH →(conc.H_2SO_4, heat)→ CH_2=CH_2 + H_2O \]
(ইথানল থেকে ইথিন প্রস্তুতি)
সম্পৃক্ত হাইড্রোকার্বন থেকে হাইড্রোজেন অপসারণ করে অ্যালকেন প্রস্তুত করা হয়।
প্রতিক্রিয়া:
\[ CH_3CH_3 →(heat, Ni)→ CH_2=CH_2 + H_2 \]
দ্বৈত বন্ধন তৈরি করার জন্য অ্যালকেন প্রস্তুতিতে বিজারণ বিক্রিয়া ব্যবহার করা হয়। এটি সাধারণত অ্যালকোহল বা হ্যালোজেনযুক্ত যৌগে ঘটে।
অ্যালকেন ব্রোমিন ওয়াটারের রঙ দ্রুত অপসারণ করে। এটি অ্যালকেন শনাক্ত করার একটি গুরুত্বপূর্ণ পরীক্ষামূলক পদ্ধতি।
প্রতিক্রিয়া:
\[ CH_2=CH_2 + Br_2 → CH_2Br-CH_2Br \]
(ব্রোমিনের কমলা রঙ অপসারিত হয়।)
অ্যালকেন পটাসিয়াম পারম্যাঙ্গানেটের জলের সাথে বিক্রিয়া করে এর বেগুনি রঙ অপসারণ করে।
প্রতিক্রিয়া:
\[ CH_2=CH_2 + KMnO_4 + H_2O → CH_2OH-CH_2OH + MnO_2 \]
(অ্যাথিনল তৈরি হয় এবং রঙহীন দ্রবণ দেখা যায়।)
অ্যালকেন ওজোনের সাথে বিক্রিয়া করে ওজোনাইড তৈরি করে, যা শনাক্তকরণের জন্য ব্যবহৃত হয়।
প্রতিক্রিয়া:
\[ CH_2=CH_2 + O_3 → CH_2O + CH_2O \]
(ফর্মালডিহাইড উৎপন্ন হয়।)
অ্যালকেন সম্পূর্ণ দহন করে কার্বন ডাই অক্সাইড ও জল তৈরি করে, যা শনাক্তকরণের জন্য ব্যবহৃত হয়।
প্রতিক্রিয়া:
\[ CH_2=CH_2 + 3O_2 → 2CO_2 + 2H_2O \]
এই আলোচনায় অ্যালকেন প্রস্তুতি এবং এর শনাক্তকরণে ব্যবহৃত প্রধান পরীক্ষাগুলি ব্যাখ্যা করা হয়েছে।
অ্যালকিন প্রস্তুতির জন্য বিভিন্ন পদ্ধতি ব্যবহার করা হয়। প্রধান পদ্ধতিগুলো নিম্নরূপ:
এটি হ্যালোআলকেন থেকে হাইড্রোজেন ও হ্যালোজেন পরমাণু অপসারণের মাধ্যমে অ্যালকিন প্রস্তুত করার একটি পদ্ধতি।
প্রতিক্রিয়া সমীকরণ:
\[
RCH_2CHX + KOH \rightarrow RCH = CH + KX + H_2O
\]
পদ্ধতি:
এথানল বা ইথাইল অ্যালকোহলকে উপযুক্ত বিক্রিয়কের উপস্থিতিতে গরম করলে অ্যালকিন তৈরি হয়।
প্রতিক্রিয়া সমীকরণ:
\[
C_2H_5OH \xrightarrow{\text{H}_2SO_4} C_2H_4 + H_2O
\]
ভিসিনাল বা জেমিনাল ডাইহ্যালাইডে জিঙ্কের গুঁড়া ব্যবহার করে অ্যালকিন প্রস্তুত করা যায়।
প্রতিক্রিয়া সমীকরণ:
\[
RCX_2 + 2[H] \rightarrow RC \equiv CH + 2HX
\]
অ্যালকাইনকে লিন্ডলার ক্যাটালিস্ট ব্যবহার করে আংশিক হাইড্রোজেনেশন করলে অ্যালকিন উৎপন্ন হয়।
প্রতিক্রিয়া সমীকরণ:
\[
R-C \equiv C-R + H_2 \xrightarrow{\text{Lindlar Catalyst}} R-CH = CH-R
\]
অ্যালকিন শনাক্তকরণের জন্য বেশ কিছু পরীক্ষার ব্যবহার করা হয়। এগুলো হলো:
অ্যালকিন ব্রোমিনের জলের সাথে বিক্রিয়া করে এর লালচে বাদামি রঙ অদৃশ্য করে। এটি অ্যালকিন শনাক্তকরণের একটি গুরুত্বপূর্ণ পরীক্ষা।
প্রতিক্রিয়া সমীকরণ:
\[
CH \equiv CH + Br_2 \rightarrow CHBr = CHBr
\]
অ্যালকিনে পটাসিয়াম পারম্যাঙ্গানেট (KMnO₄) দ্রবণের সাথে বিক্রিয়া করলে গোলাপি রঙ অদৃশ্য হয়। এটি অ্যালকিনের উপস্থিতি নির্দেশ করে।
প্রতিক্রিয়া সমীকরণ:
\[
CH \equiv CH + KMnO_4 \rightarrow CH(OH) = CH(OH)
\]
প্রান্তীয় অ্যালকিন অ্যামোনিয়াকাল সিলভার নাইট্রেট বা কপার ক্লোরাইডের সাথে বিক্রিয়া করে পুঁজ-সাদাটে বা লালচে রঙের বস্তুর উৎপত্তি করে।
প্রতিক্রিয়া সমীকরণ:
\[
RC \equiv CH + AgNO_3 \rightarrow RC \equiv CAg + HNO_3
\]
এটি শুধুমাত্র প্রান্তীয় অ্যালকিন শনাক্ত করতে ব্যবহৃত হয়।
সারাংশ:
অ্যালকিন প্রস্তুতির জন্য বিভিন্ন পদ্ধতি যেমন ডিহাইড্রোহ্যালোজেনেশন, ডিহাইড্রেশন, এবং ডাইহ্যালাইড থেকে প্রস্তুতি প্রযোজ্য। অ্যালকিন শনাক্তকরণে ব্রোমিন পরীক্ষা, বেয়ারের পরীক্ষা, এবং প্রান্তীয় অ্যালকিন শনাক্তকরণের পদ্ধতি কার্যকর।
২-মিথাইল বিউট-১-ইন
২-বিউটিন
৩-মিথাইল বিউট-১-ইন
২-মিথাইল বিউট- ২-ইন
অ্যালকাইন হলো হাইড্রোকার্বনের একটি বিশেষ শ্রেণি, যার অণুতে অন্তত একটি ত্রৈ-বন্ধন (C≡C) থাকে। এটি সাধারণত ল্যাবরেটরিতে এবং শিল্পক্ষেত্রে বিভিন্ন প্রক্রিয়ার মাধ্যমে প্রস্তুত করা হয়। নিচে অ্যালকাইনের প্রস্তুতির প্রধান পদ্ধতিগুলো তুলে ধরা হলো।
ক্যালসিয়াম কার্বাইডকে (CaC₂) জলীয় পরিবেশে বিক্রিয়া করালে অ্যাসিটিলিন (C₂H₂) তৈরি হয়:
\[
CaC_2 + 2H_2O \rightarrow C_2H_2 + Ca(OH)_2
\]
এটি একটি সহজ এবং প্রচলিত পদ্ধতি, বিশেষ করে অ্যাসিটিলিন প্রস্তুত করতে।
ভিন্ন ভিন্ন হ্যালোজেনযুক্ত এলকেনের বিক্রিয়া থেকে অ্যালকাইন প্রস্তুত করা যায়। যেমন:
\[
CH_2BrCH_2Br + 2KOH \rightarrow HC≡CH + 2KBr + 2H_2O
\]
এই পদ্ধতিতে এলকেনকে শক্তিশালী ক্ষারীয় পরিবেশে উত্তপ্ত করলে ত্রৈ-বন্ধন গঠিত হয়।
এলকিনকে হাইড্রোজেনেশন করে অ্যালকাইন তৈরি করা যায়:
\[
C_2H_4 + H_2 \rightarrow C_2H_6
\]
তবে এই প্রক্রিয়া সাধারণত শিল্পক্ষেত্রে ব্যবহৃত হয়।
অ্যালকাইন শনাক্ত করার জন্য কিছু বিশেষ রাসায়নিক বিক্রিয়া রয়েছে, যা অ্যালকাইনের উপস্থিতি নির্দেশ করে।
অ্যালকাইন ব্রোমিনের পানির সঙ্গে বিক্রিয়া করে এর লালচে-বাদামী রং হারিয়ে ফেলে। এটি একটি বৈশিষ্ট্যপূর্ণ পরীক্ষা:
\[
C_2H_2 + Br_2 \rightarrow C_2H_2Br_2
\]
ব্রোমিনের রঙ পরিবর্তন অ্যালকাইনের উপস্থিতি নির্দেশ করে।
অ্যাসিটিলিন জাতীয় অ্যালকাইন AgNO₃-তে বিক্রিয়া করে সাদা বা হলদেটে প্রাসিপিটেট তৈরি করে। উদাহরণ:
\[
C_2H_2 + AgNO_3 \rightarrow C_2Ag_2 + HNO_3
\]
এই প্রক্রিয়া দিয়ে অ্যালকাইন শনাক্ত করা যায়।
অ্যালকাইন শক্তিশালী অক্সিডাইজিং এজেন্ট, যেমনঃ পটাসিয়াম পারম্যাঙ্গানেট (KMnO₄) দিয়ে বিক্রিয়া করে অ্যালকোহল তৈরি করে:
\[
HC≡CH + KMnO_4 \rightarrow COOH + H_2O
\]
এই পদ্ধতিতে অ্যালকাইনের উপস্থিতি শনাক্ত করা সম্ভব।
অ্যালকাইল হ্যালাইড : সম্পৃক্ত হাইড্রোকার্বন বা অ্যালকেন অণু থেকে একটিমাত্র হাইড্রোজেন পরমাণু হ্যালোজেন পরমাণু দ্বারা প্রতিস্থাপিত হলে যে যৌগ শ্রেণি পাওয়া যায় তাকে অ্যালকাইল হ্যালাইড বলে। এর সাধারণ সংকেত R – X।
অ্যারাইল হ্যালাইড : বেনজিন চক্রে হ্যালোজেনসমূহ প্রতিস্থাপক হিসেবে থাকলে তাদেরকে অ্যারাইল হ্যালাইড বলে। যেমন, ক্লোরোবেনজিন (C6H5Cl), ব্রোমোবেনজিন (C6H5Br) ইত্যাদি। অ্যারাইল হ্যালাইডের সাধারণ সংকেত Ar – X। Ar দ্বারা ফিনাইল (C6H5) বা প্রতিস্থাপিত বোঝানো হয়।
অ্যালকোহল হলো এমন একটি জৈব যৌগ যা হাইড্রোক্সিল (–OH) গ্রুপ ধারণ করে। অ্যালকোহল সাধারণত হাইড্রোকার্বনের হাইড্রোজেন প্রতিস্থাপন করে গঠিত হয়। এদের সাধারণ রাসায়নিক সংকেত R–OH।
ইথার হলো একটি জৈব যৌগ যেখানে দুটি অ্যালকাইল বা অ্যারাইল গ্রুপ একটি অক্সিজেন পরমাণুর মাধ্যমে সংযুক্ত থাকে। ইথারের সাধারণ রাসায়নিক সংকেত R–O–R'।
অ্যামিন হলো জৈব যৌগ যা অ্যামোনিয়া (NH₃)-এর উৎপন্ন। এতে হাইড্রোজেন পরমাণুগুলো অ্যালকাইল বা অ্যারাইল গ্রুপ দ্বারা প্রতিস্থাপিত হয়। অ্যামিনের সাধারণ রাসায়নিক সংকেত R–NH₂, R₂–NH, অথবা R₃–N।
ইথার কি? (What is Ether in Bengali/Bangla?)
দুটি অ্যালকাইল বা দুটি অ্যারাইল গ্রুপ বা একটি অ্যালকাইল ও একটি অ্যারাইল গ্রুপ একটি অক্সিজেন পরমাণুর মাধ্যমে পরস্পর যুক্ত থাকলে যে শ্রেণির যৌগ গঠিত হয়, তাদের ইথার বলে। ইথারের সাধারণ সংকেত R-O-R´ যেখানে R ও R´ হল অ্যালকাইল বা অ্যারাইল গ্রুপ। R ও R´ উভয়ই অ্যালকাইল গ্রুপ হলে, সেই ইথারকে অ্যালিফেটিক ইথার এবং কোনো একটি বা উভয়েই অ্যারাইল গ্রুপ হলে, সেই ইথারকে অ্যারোমেটিক ইথার বলে। ইথার ও মনোহাইড্রিক অ্যালকোহল উভয়েরই সাধারণ সংকেত CnH2n+2O। সুতরাং একই সংকেত বিশিষ্ট ইথার ও মনোহাইড্রিক অ্যালকোহল পরস্পরের সমাণু। কম আণবিক ভর বিশিষ্ট ইথারসমূহ সাধারণ উষ্ণতায় গ্যাসীয় বা উদ্বায়ী তরল পদার্থ এবং দাহ্য।
ইথারের অণুতে H-বন্ধন গঠনের জন্য প্রয়োজনীয় আম্লিক প্রোটন নেই। তাই ইথারকে প্রোটন বিহীন দ্রাবক বলা হয়।
ইথার ও অ্যালকোহলের মধ্যে পার্থক্য কি?

ইথারের সাধারণ সংকেত হল R–O–R এবং অ্যালকোহলের সাধারণ সংকেত হল R–O–H। ইথারের কার্যকরী মূলক হচ্ছে ≡C–O–
C≡ এবং অ্যালকোহলের কার্যকরী মূলক হচ্ছে ≡C–O–H। ফলে অ্যালকোহল অপেক্ষা ইথার রাসায়নিকভাবে কম সক্রিয় হয়। নিচে ইথার ও অ্যালকোহলের পার্থক্য তুলে ধরা হলো–
ইথার
অ্যালকোহল
প্রশ্নঃ আলিফ্যাটিক অ্যামিন প্রস্তুতির সাধারণ পদ্ধতিগুলো উল্লেখ কর। (General methods of preparation of Aliphatic Amine)
উত্তর:
(i) অ্যালকাইল হ্যালাইড এবং অ্যামোনিয়া হতে (From Alkyl Halide and Ammonia):
ইথানল দ্রবীভূত অ্যালকাইল হ্যালাইড ও অ্যামোনিয়া গ্যাসের মিশ্রণকে আবদ্ধ পাত্রে উত্তপ্ত করা হলে অ্যামোনিয়ার H-পরমাণু অ্যালকাইল মূলক দ্বারা প্রতিস্থাপিত হয়ে 1,° 2°, 3° অ্যামিনসমূহ এবং 4°-অ্যামিমানিয়া লবণের মিশ্রণ উৎপন্ন হয়।
যেমন- RX alc+ NH3 (alc) → [R-NH3]X-
উদাহরণ:
CH3I+NH3→ R-NH3X –
CH3I + CH3NH3I- →CH32-NH+H2O+KI
CH3I + CH33NH2I- → CH33NHI- + HI
CH3I + CH33NHI-CH34 NI- + HI
উৎপন্ন অ্যামিনসমূহের মিশ্রণে পটাশিয়াম হাইড্রক্সাইড ক্ষার দ্রবণ যোগ করে আংশিক পাতন করলে পৃথক পৃথকভাবে 1° ,2° , 3° অ্যামিন পাওয়া যায়।
যেমন-
CH3NH3I + KOH → CH3 – NH2 + H2O+ KI
CH32NH2I- + KOH → CH32 – NH + H20+ KI
CH33NHI- + KOH + CH32N +H20+ KI
4° অ্যামোনিয়াম লবণ পাতিত হয় না বিধায় এটি পাতন ফ্লাস্কে থেকে যায়। এভাবে 1°,2°,3° অ্যামিন প্রস্তুত করা যায় ।
(ii) অ্যালকেন নাইট্রাইল বা অ্যালকাইল সায়ানাইড হতে (From Alkene nitrile or Alkyl Cyanide): শুষ্ক ইথারে দ্রবীভূত লিথিয়াম অ্যালুমিনিয়াম হাইড্রাইড (LiAIH4) দ্বারা অ্যালকাইল সায়ানাইডকে বিজারিত করে প্রাইমারী অ্যামিন প্রস্তুত করা যায় ।
R-CN +4HLiAlH→ শুষ্ক ইথার R – CH2 – NH2
উদাহরণ:
CH3- CN + 4[H] LiAlH→CH3– CH2-NH2
মিথাইল সায়নাইড ইথাইল অ্যামিন
অনুরুপে,
CH3 –NC + 4HLiAlH→ CH3– NH-CH3 (2° অ্যামিন)
মিথাইল আইসো সায়ানাইড ডাই মিথাইল অ্যামিন
(iii) নাইট্টো যৌগের বিজারণ দ্বারা (Reduction of Nitto compounds): নাইট্রো অ্যালকেনকে টিন এবং HCl সহযোগে উত্তপ্ত করা হলে বিজারনের মাধ্যমে প্রাইমারী অ্যামিন পাওয়া যায়।
R– NO2 + 6[H] Sn+HCl→ R– NH2 + 2H2O
উদাহরণ:
CH3– NO2 + 6HSn+HCl→ CH3 – NH2+ 2H2O
নাইট্টো মিথেন মিথাইল অ্যামিন
প্রশ্ন: পরীক্ষাগারে মিথাইল অ্যামিন প্রস্তুতি বর্ণনা কর। (Preparation of Methyl Amine in the laboratory)
উত্তর: মূলনীতি ও ইথান্যামাইড (CH3CONH2), ব্রোমিন ও গাঢ় কষ্টিক পটাশ দ্রবণকে একত্রে উত্তপ্ত করে পরীক্ষাগারে মিথাইল অ্যামিন (CH3 – NH2) প্রস্তুত করা যায়। এ বিক্রিয়ায় অতিরিক্ত উৎপাদ পটাশিয়াম ব্রোমাইড, পটাশিয়াম কার্বনেট ও পানি উৎপন্ন হয়। এ বিক্রিয়াকে হফম্যান ডিগ্রেডেশন বিক্রিয়া বলে।
CH3CONH2 + Br2 + 4KOH∆→ CH3 – NH2 + 2KBr + K2CO3 + 2H2O
প্রশ্ন: মিথাইল অ্যামিন হতে কিভাবে মিথাইল কাৰ্বিল অ্যামিন বা মিথাইল আইসো সায়ানাইড পাওয়া যায়? (How to get Methyl Carbylamine or Methyl isocyanate from Methyl Amine?)
উত্তর: ক্লোরোফম CHCl3 ও কস্টিক পটাশ KOH দ্রবণের সাথে মিথাইল অ্যামিন উত্তপ্ত করা হলে উগ্র গন্ধযুক্ত মিথাইল
কার্বিল অ্যমিন (CH3-NC) উৎপন্ন হয়।
CH2-NH2CHCl-3KOH + CH3-NC+3KCl+3H2O
প্রশ্ন: বিভিন্ন ধরনের অ্যামিনের সাথে নাইটাস এসিডের বিক্রিয়ায় কি ঘটে? অথবা 𝟏,° 𝟐°, 𝟑° এ্যালিফেটিক অ্যামিনের মধ্যে কিরুপে পার্থক্য নির্ণয় করা যায়? (What happens when Nitrous acid reacts with different types of amines)
উত্তর:
(i) প্রাইমারী অ্যামিনের সাথে বিক্রিয়া (Reaction with primary amine): ইথাইল অ্যামিন নাইট্রাস এসিডের সাথে বিক্রিয়া করে বুদবুদ আকারে নাইট্রোজেন গ্যাস উৎপন্ন। করে সাথে ইথানল এবং H2O উৎপন্ন হয়।
C2H5+ NH2+ HNO3NaNO3+HCl→ C2H5 – OH + N2(q) +H2O
ইথানল
(ii) সেকেন্ডারী অ্যামিনের সাথে বিক্রিয়া (Reaction with secondary amine): ডাইমিথাইল অ্যামিন নাইট্রাস এসিডের সাথে বিক্রিয়া করে ডাই মিথাইল নাইট্রোসো অ্যামিন নামক হলুদ বর্ণের তৈলাক্ত পদার্থ উৎপন্ন করে সাথে H2O উৎপন্ন হয়।
CH32NH + HNO3NaNO3+HCl→ CH32N-NO + H2O
ডাই মিথাইল নাইট্রোসো অ্যামিন
iii টারশিয়ারী অ্যামিনের সাথে বিক্রিয়া (Reaction with tertiary amine): টাই মিথাইল অ্যামিন নাইট্রাস
এসিডের সাথে বিক্রিয়া করে ট্রাই মিথাইল অ্যামোনিয়াম। নাইট্রাইট নামক দ্রবণীয় লুবণ উৎপন্ন হয়।
CH33 N + HNO2NaNO2+HCl→CH32N+HNO-2
ট্রাই মিথাইল অ্যামোনিয়াম নাইট্রাইট
প্রশ্ন: অ্যারোমেটিক অ্যামিন প্রস্তুতির সাধারণ পদ্ধতিগুলো উল্লেখ কর। (General methods of preparing of Aromatic Amines)
উত্তর:
i নাইট্রো যৌগের বিজারণের মাধ্যমে ও অ্যারোমেটিক নাইট্রো যৌগকে টিন এবং HCl এসিড দ্বারা বিজারিত করা হলে
অ্যারোমেটিক প্রাইমারী অ্যামিন উৎপন্ন হয়।
Ar – NO2 + 6HSn+HCl→ Ar – NH2 + 2H2O
উদাহরণ:
(ii) অ্যামাইড যৌগ হতে: অ্যারাইল অ্যামাইডকে ব্রোমিন ও গাঢ় KOH দ্রবণসহ উত্তপ্ত করা হলে প্রাইমারী
অ্যারোমেটিক অ্যামিন উৎপন্ন হয়। এ বিক্রিয়াকেও হ্যাফম্যান ডিগ্রেডেশন বিক্রিয়া বলে।
Ar – CONH2 + Br2 + 4KOH→ Ar – NH2 + 2KBr+K2CO3 + 2H2O
উদাহরণ:
অ্যামিন (Amine)
অ্যানিলিন (Aniline)
প্রশ্ন : অ্যানিলিনের পরীক্ষাগার প্রস্তুতি বর্ণনা কর। (Laboratory preparation of aniline)
উত্তর: পরীক্ষাগারে নাইট্রোবেনজিনকে টিন ও গাঢ় HCl দ্বারা উত্তপ্ত করা হলে Sn এবং FICI এর বিক্রিয়ায়
উৎপন্ন জায়গান হাইড্রোজেন নাইট্রোবেনজিনকে বিজারিত করে অ্যানিলিনে পরিণত করে।
প্রশ্ন: অ্যানিলিনের সাথে ইথানোয়িল ক্লোরাইডের বিক্রিয়ায় কি ঘটে? (Reaction between Aniline and Ethanoyl chloride)
উত্তর: অ্যানিলিন ইথানায়িল ক্লোরাইড বা এসিটাল ক্লোরাইড (CH3COCI) সাথে বিক্রিয়া করে
N-ফিনাইল ইথানামাইড বা এসিটানিলাইড উৎপন্ন করে।
প্রশ্ন: অ্যানিলিন হতে কিভাবে ফেনল পাওয়া যায়? (Aniline to Phenol)
উত্তর: অ্যানিলিনকে NaNO2 এবং HCl এর মিশ্রণে উত্তপ্ত করা হলে NaNO2, এবং HCl এর বিক্রিয়ায়
উৎপন্ন নাইট্রাস এসিড (HNO2) অ্যানিলিনের সাথে বিক্রিয়া করে ফেনল উৎপন্ন হয়। সাথে N2 এবং H2O উৎপন্ন হয়।
প্রশ্ন: অ্যানিলিন হতে কিভাবে ফিনাইল কাৰ্বিল অ্যামিন পাওয়া যায়? (Aniline to Phenyl carbylamine)
উত্তর: অ্যানিলিন, ক্লোরোফরম CHCl3 এবং অ্যালকোহলীয় KOH দ্রবণের সাথে উত্তপ্ত করা হলে
উগ্র গন্ধযুক্ত ফিনাইল কাৰ্বিল অ্যামিন বা ফিনাইল আইসো সায়ানাইড পাওয়া যায়।
প্রশ্ন: অ্যানিলিন হতে কিভাবে সালফানিলিক এসিড পাওয়া যায়? (Aniline to Sulfanilic acid)
উত্তর: অ্যানিলিনকে ধুমায়িত সালফিউরিক এসিডের সাথে 180-200°C তাপমাত্রায় উত্তপ্ত করলে উভয়ের মধ্যে বিক্রিয়ার মাধ্যমে সালফানিলিক এসিড বা 4-অ্যামিনো বেনজিন সালফোনিক এসিড ও পানি উৎপন্ন হয়।
প্রশ্ন: অ্যানিলিন ব্রোমিন দ্রবণে চালনা করা হলে কী ঘটে? (What happens when Aniline is treated with Aqueous Bromine)
উত্তর: অ্যানিলিন ব্রোমিনের জলীয় দ্রবণে চালনা করা হলে উভয়ের মধ্যে দ্রুত বিক্রিয়ার মাধ্যমে 2, 4, 6-ট্রাই ব্রোমো অ্যানিলিন উৎপন্ন হয়।
ডায়াজোনিয়াম লবণ (Diazonium salts)
প্রশ্ন: ডায়াজোনিয়াম লবণ কাকে বলে? (Diazonium salts)
উত্তর: দুটি নাইট্রোজেন পরমাণু বিশিষ্ট ডায়াজো (-N+ = N) মূলকের একটি যোজনী বেনজিন বলয়ের একটি কার্বন পরমাণুর সাথে এবং অপর যোজনী একটি অজৈব এসিড মূলক (যেমন- CI-, Br- , NO3- ইত্যাদি) এর সাথে যুক্ত হয়ে যে যৌগ উৎপন্ন করে, তাদেরকে ডায়াজোনিয়াম লবণ বলে।
উদাহরণ: বেনজিন ডায়াজোনিয়াম ক্লোরাইড একটি ডায়াজোনিয়াম লবণ। যার সংকেত-
প্রশ্ন: ডায়াজোটাইজেশন বা ডায়াজোকরণ বলতে কী বুঝ? (Diazotization)
উত্তর: যে প্রক্রিয়ায় কোন অ্যারোমেটিক প্রাইমারী অ্যামিন নিম তাপমাত্রায় (0 – 5°C) খনিজ এসিডের উপস্থিতিতে নাইট্রাস এসিডের সাথে বিক্রিয়া করে ডায়াজোনিয়াম লবণে রূপান্তরিত হয় তাকে ডায়াজোকরণ বলে ।
উদাহরণ: অ্যানিলিন, সোডিয়াম নাইট্রাইট (NaNO2) ও HCl এর মিশ্রণকে 0 – 5°C তাপমাত্রার নিচে শীতল করা হলে বেনজিন ডায়াজোনিয়াম ক্লোরাইড উৎপন্ন হয়।
প্রশ্ন: বেনজিন ডায়াজোনিয়াম ক্লোরাইডের পরীক্ষাগারে বর্ণনা কর। (Describe Benzene diazonium chloride in the laboratory)
উত্তর :
মূলনীতি: পরীক্ষাগারে হাইড্রোক্লোরিক এসিড দ্রবীভূত অ্যানিলিন দ্রবণের তাপমাত্রাকে 0 – 5°C তাপমাত্রার নিচে নামিয়ে এর মধ্যে ধীরে ধীরে সোডিয়াম নাইট্রাইট (NaNO2) দ্রবণ যোগ করলে বেনজিন ডায়াজোনিয়াম ক্লোরাইড উৎপন্ন।
প্রশ্ন: বেনজিন ডায়াজোনিয়াম ক্লোরাইড হতে বেনজিন কিরূপে পাওয়া যায়? (How Benzene is obtained from Benzenediazonium chloride)
উত্তর: বেনজিন ডায়াজোনিয়াম ক্লোরাইডকে হাইপোফসফরাস এসিডের সাথে উত্তপ্ত করা হলে হাইপোফসফরাস (H3PO2) এসিড ডায়াজোনিয়াম ক্লোরাইডকেজিারিত করে বেনজিনে পরিণত করে। সাথে ফসফরাস এসিড (H3PO3), N2 এবং HCl উৎপন্ন হয়।
প্রশ্ন: বেনজিন ডায়াজোনিয়াম ক্লোরাইড হাতে ফেনল কিভাবে পাওয়া যায়? (How Phenol is obtained from Benzenediazonium chloride)
উত্তর: বেনজিন ডায়াজোনিয়াম ক্লোরাইডকে এসিডের উপস্থিতিতে আর্দ্র বিশ্লেষণ করা হলে আর্দ্র বিশ্লেষণের ফলে ফেনল, N2 গ্যাস ও HCl – উৎপন্ন হয়।
প্রশ্ন: বেনজিন ডায়াজোনিয়াম ক্লোরাইড হতে ক্লোরো বেনজিন কিভাবে পাওয়া যায়? (How to get Chlorobenzene from Benzenediazonium chloride)
উত্তর: বেনজিন ডায়াজোনিয়াম ক্লোরাইডের সাথে সমপরিমাণ কপার (I) ক্লোরাইড ও গাঢ় HCl এসিড মিশ্রিত করে ঐ মিশ্রণকে 100°c তাপমাত্রায় উত্তপ্ত করা হলে ডায়াজোনিয়াম লবণের ডায়াজোমূলক ক্লোরিন পরমানু দ্বারা প্রতিস্থাপতি হয়ে ক্লোরোবেনজিন উৎপন্ন হয়। এ বিক্রিয়াকে স্যান্ডমেয়ার বিক্রিয়া বলে।
অনুরূপে,
প্রশ্ন: বেনজিন ডায়াজোনিয়াম ক্লোরাইড হতে বেনজয়িক এসিড কিভাবে পাওয়া যায়? (Benzenediazonium chloride to Benzoic acid)
উত্তর: বেনজিন ডায়াজোনিয়াম লবণকে পটাশিয়াম সায়ানাইডের জলীয় দ্রবণে দ্রবীভূত কিউপ্রাস সায়ানাইড, Cu2CN2 এর সাথে উত্তপ্ত করা হলে ডায়াজোমূলক (-N2Cl) সায়ানাইড মূলক (-CN) দ্বারা প্রতিস্থাপিত হয়ে ফিনাইল সায়ানাইড উৎপন্ন করে। উৎপন্ন সায়ানাইডকে অন্নীয় মাধ্যমে আর্ল বিশ্লেষণ করা হলে বেনজয়িক এসিড এবং অ্যামোনিয়া উৎপন্ন করে।
প্রশ্ন: বেনজিন ডায়াজোনিয়াম ক্লোরাইড হেত বেনজাইল অ্যামিন কিভাবে পাওয়া যায়? (Benzenediazonium chloride to Benzyl Amine)
উত্তর: বেনজিন ডায়াজোনিয়াম লবণকে পটাশিয়াম সায়ানাইডের (KCN) জলীয় দ্রবণে দ্রবীভূত কিউপ্রাস সায়ানাইড, Cu2CN2 এর সাথে উত্তপ্ত করা হলে ফিনাইল সায়ানাইড পাওয়া যায়। উৎপন্ন ফিনাইল সায়ানাইডকে লিথিয়াম অ্যালুমিনিয়াম হাইড্রাইড দ্বারা বিজারিত করে বেনজাইল অ্যামিন উৎপন্ন হয়।
প্রশ্ন: বেনজিন ডায়াজোনিয়াম ক্লোরাইড হতে আয়োডোবেনজিন কিভাবে পাওয়া যায়? (Benzenediazonium chloride to Iodobenzene)
উত্তর: বেনজিন ডায়াজোনিয়াম ক্লোরাইডকে পটাশিয়াম আয়োডাইডের সাথে উত্তপ্ত করলে আয়োডো বেনজিন উৎপন্ন হয়। সাথে N2KCl পাওয়া যায়।
প্রশ্ন: বেনজিন ডায়াজোনিয়াম ক্লোরাইড হতে কিভাবে অ্যানিলিন পাওয়া যায়? (Benzenediazonium chloride to Aniline)
উত্তর : বেনজিন ডায়াজোনিয়াম ক্লোরাইডকে Zn এবং HCl এর মিশ্রণ বা LiAlH4 দ্বারা বিজারিত করা হলে অ্যানিলিন ও অ্যামোনিয়াম। ক্লোরাইড (NH4Cl) উৎপন্ন হয়।
প্রশ্ন: বেনজিন ডায়াজোনিয়াম ক্লোরাইড হতে ফিনাইল হাইড্রাজিন কিভাবে পাওয়া যায়? (Benzenediazonium chloride to Phenyl Hydrazine)
উত্তর: বেনজিন ডায়াজোনিয়াম ক্লোরাইডকে টিন (II) ক্লোরাইড (SnCl2) এবং HCl মিশ্রণ থেকে উৎপন্ন জায়গায় হাইড্রোজেন দ্বারা বিজারিত করলে ফিনাইল হাইড্রাজিন ও HCl উৎপন্ন হয়।
অ্যামিন (Amine)
প্রশ্ন: মিথাইল অ্যামিন অ্যামোনিয়া অপেক্ষা তীব্রতর ক্ষারক কেন? (Methylamine is a stronger base than ammonia)
উত্তর: প্রোটনীয় মতবাদ অনুসারে কোন যৌগের পোটন (H+) গঠrণর ক্ষমতা যৌগটির সঞ্চারধর্মের পরিমাপ বাদ অনুসারে কোন যৌগের প্রোটন (li’) গ্রহণের ক্ষমতা যৌগটির ক্ষারধর্মের পরিমাপক। উপরের গঠন হতে দেখা যায় উভয়ের নাইট্রোজেন পরমাণুতে নি:সঙ্গ ইলেক্ট্রন জোড় আছে। লুইস মতবাদ অনুযায়ী নাইট্রোজেনের উপর নি:সঙ্গ ইলেক্ট্রন যুগলের প্রাপ্যতা যত বৃদ্ধি পাবে, প্রোটন গ্রহণ ক্ষমতা তত বাড়বে এবং সাথে সাথে ক্ষারকের শক্তিও তত বেড়ে যাবে। মিথাইল অ্যামিনের নাইট্রোজেন পরমাণুর সাথে যুক্ত মিথাইল মূলকের ধণাত্মক আবেশীয় (+I) ধর্ম আছে বিধায় এটি নাইট্রোজেন পরমাণুর দিকে ইলেক্ট্রন ঠেলে দিয়ে নাইট্রোজেন পরমাণুর ইলেক্ট্রন ঘনত্ব বৃদ্ধি করে।
ফলে প্রোটনের (H’) সাথে বিক্রিয়ার জন্য ইলেক্ট্রনের প্রাপ্যতা বৃদ্ধি পায়। তাই মিথাইল অ্যামিনের ক্ষেত্রে নিমোক্ত বিক্রিয়া অধিকতর সম্মুখমুখী হয়। ফলে দ্রবণে OH- আয়নের পরিমাণ বৃদ্ধি পাওয়ায় kb এর মান বৃদ্ধি পায়। অর্থাৎ Pkb এর মান হ্রাস পায় কিন্তু অ্যামোনিয়ার অণুতে এ ধরনের প্রভাব সম্ভব নয়। ফলে মিথাইল অ্যামিন অ্যামোনিয়া অপেক্ষা তীব্রতর ক্ষারক।
CH3 – NH2+ H20 Pkb=3.36↔CH3- NH3 + OH-
NH3 + H20Pkb=4.74↔ NH4++ OH-
প্রশ্ন: ১°, ২°, ৩° অ্যামিনের ক্ষারকন্তু এর তুলনামূলক আলোচনা কর। (Alkalinity of 1°, 2°, 3° Amine)
উত্তর: মিথাইল অ্যামিন (১°), ডাই মিথাইল অ্যামিন (২°) এবং টারশিয়ারী অ্যামিনের (৩°) গঠন নিয়ে দেওয়া গেল-
প্রোটনীয় মতবাদ অনুসারে কোন যৌগের প্রোটন (H+) গ্রহণের ক্ষমতা যৌগটির ক্ষারধর্মের পরিমাপক। উপরের গঠন হতে দেখা যায় তিন যৌগের নাইট্রোজেন পরমাণুতে নি:সঙ্গ ইলেক্ট্রন জোড় আছে। লুইস মতবাদ অনুসারে নাইট্রোজেনের উপর নি:সঙ্গ ইলেক্ট্রন যুগলের প্রাপ্যতা যত বৃদ্ধি পাবে, প্রোটন গ্রহণ ক্ষমতা তত বাড়বে এবং সাথে সাথে ক্ষারকের শক্তিও তত বেড়ে যাবে। মিথাইল অ্যামিনের নাইট্রোজেন পরমাণুর সাথে যুক্ত মিথাইল মূলকের ধণাত্মক আবেশীয় ধর্ম আছে বিধায় এটি নাইট্রোজেন পরমাণুর দিকে ইলেক্ট্রন ঠেলে দিয়ে পরমাণুর ইলেক্ট্রন ঘনত্ব বৃদ্ধি করে, ফলে প্রোটনের সাথে বিক্রিয়ার জন্য ইলেক্ট্রনের প্রাপ্যতা বৃদ্ধি পায়।
ফলে মিথাইল অ্যামিনের ক্ষারকত্ব বৃদ্ধি পায়। অপরদিকে ডাইমিথাইল অ্যামিনে দুটি মিথাইল মূলক N-পরমাণুর সাথে যুক্ত থাকে। ফলে ডাইমিথাইল অ্যামিনের N-পরমাণুতে ইলেক্ট্রন। ঘনতু মিথাইল অ্যামিনের N-পরমাণুর ইলেক্ট্রন ঘনত্ব অপেক্ষা অধিক হয় এবং ডাই মিথাইল অ্যামিন অপেক্ষা অধিক প্রোটন আকর্ষী হয়। কিন্তু ট্রাইমিথাইল অ্যামিনে তিনটি মিথাইলমূলক যুক্ত থাকলেও এর ক্ষারকীয় ধর্ম ডাই মিথাইল অ্যামিন অপেক্ষা কম। এর কারণ ট্রাই মিথাইল অ্যামিনে তিনটি মিথাইল মূলক থাকায় ষ্টেরিক বাধার কারণে N-পরমাণুতে প্রোটন যুক্ত হতে বাধাপ্রাপ্ত হয়। যার কারণে ট্রাইমিথাইল অ্যামিনের ক্ষারীয় ধম ডাই মিথাইল অ্যামিনের ক্ষারীয় ধর্ম হতে অপেক্ষাকৃত কম। ষ্টেরিক বাধা এবং ইলেক্ট্রনের প্রাপ্যতা এই দুইয়ের উপর ভিত্তি করে P এর মান হতে ক্ষারকত্নের ক্রম নিমরূপে সাজানো যায়।
২° অ্যামিন >১° অ্যামিন > ৩° অ্যামিন
প্রশ্ন: মিথাইল অ্যামিন এবং অ্যানিলিনের ক্ষারধর্মীতার তুলনামূলক আলোচনা কর। (Discussion of the alkalinity of Methyl Amine and Aniline)
উত্তর: মিথাইল অ্যামিন (CH3NH2) এবং অ্যামিনিলের গাঠনিক সংকেত নিম্নরূপ-
প্রোটনীয় মতবাদ অনুসারে কোন যৌগের প্রোটন (H+) গ্রহণের ক্ষমতা যৌগটির ক্ষারধর্মের পরিমাপক। উপরের গঠন হতে দেখা যায় উভয়ের নাইট্রোজেন পরমাণুতে নি:সঙ্গ ইলেক্ট্রন জোড় আছে। লুইস মতবাদ অনুযায়ী নাইট্রোজেনের উপর নি:সঙ্গ ইলেক্ট্রন যুগলের প্রাপ্যতা যত বৃদ্ধি পাবে, প্রোটন গ্রহণ ক্ষমতা তত বাড়বে এবং সাথে সাথে ক্ষারকের শক্তিও তত বেড়ে যাবে।
মিথাইল অ্যামিনের নাইট্রোজেন পরমাণুর সাথে যুক্ত মিথাইল মূলকের ধণাত্মক আবেশীয় (+I) ধর্ম আছ বিধায় এটি নাইট্রোজেন পরমানুর দিকে ইলেক্ট্রন ঠেলে দিয়ে নাইট্রোজেন পরমাণুর ইলেক্ট্রন ঘনত্ব বৃদ্ধি করে। ফলে প্রোটনের (H+) সাথে বিক্রিয়ার জন্য ইলেক্ট্রনের প্রাপ্যতা বৃদ্ধি পায়। তাই মিথাইল অ্যামিনের ক্ষেত্রে নিম্নোক্ত বিক্রিয়া অধিকতর সম্মুখমূখী হয়। ফলে দ্রবণে OH- আয়নের পরিমাণ বৃদ্ধি পাওয়ায় kb এর মান বৃদ্ধি পায়। অর্থাৎ Pkb এর মান হ্রাস পায়।
CH3- NH2+ H20Pk = 3.36→ CH3 — NH3 + OH-
অপরদিকে অ্যানিলিন অণুতে NH2 মূলকের সঙ্গে যুক্ত N পরমাণুর নি:সঙ্গ ইলেক্ট্রন যুগল অনুরণনের মাধ্যমে আংশিকভাবে বেনজিন বলয়ের সঞ্চারণশীল ইলেক্ট্রনের সাথে মিলিত হয়। ফলে অ্যানিলিনের নাইট্রোজেন পরমাণুর উপর ইলেক্ট্রন ঘনত্ব কমে যায়। ফলে অ্যানিলিনের প্রোটন গ্রহণের ক্ষমতা কমে যায়। এ ক্ষেত্রে নিমোক্ত বিক্রিয়া সম্মুখমূখী কম ঘটায় হাইড্রক্সাইডের পরিমাণ কমে যাওয়ায় kb এর মান হ্রাস পায় অর্থাৎ Pkb এর মান বৃদ্ধি পায়।
C6H5 – NH2+ H2 Pb = 9.4↔C6H5 – NH3+ OH-
এ কারণে মিথাইল অ্যামিন অ্যানিলিন অপেক্ষা শক্তিশালী ক্ষারক।
প্রশ্ন: অ্যানিলিনের ক্ষারধর্মীতা ব্যাখ্যা কর। (Alkalinity of Aniline)
উত্তর: অ্যানিলিনের গাঠনিক সংকেত নিম্নরূপ-
প্রোটনীয় মতবাদ অনুসারে কোন যৌগের প্রোটন (H+) গ্রহণের ক্ষমতা যৌগটির ক্ষারধর্মের পরিমাপক। লুইস মতবাদ অনুযায়ী ইলেক্ট্রন জোড় দানে সক্ষম রাসায়নিক সত্ত্বাকে ক্ষারক বলে। অ্যানিলিনের N-পরমাণুতে এক জোড়া নি:সঙ্গ ইলেক্ট্রন থাকায় উহা এসিড প্রদত্ত প্রোটন গ্রহণ করে ধণাত্মক অ্যানিলিয়াম আয়ন ও শেষে অ্যানিলিয়াম লবণ উৎপন্ন করে, ফলে ইহা ক্ষারক হিসেবে আচরণ করে । হাইড্রোক্লোরিক এসিডের
সাথে অ্যানিলিনের বিক্রিয়া নিমরূপে দেখানো যায়-
তবে, অ্যানিলিনের N-পরমাণুর নি:সঙ্গ ইলেক্ট্রন যুগল অনুকরণনের মাধ্যমে আংশিকভাবে বেনজিন বলয়ের সঞ্চারণশীল পাই ইলেক্ট্রনের সাথে মিলিত হয়। ফলে নাইট্রোজেনের মুক্ত জোড় ইলেক্ট্রন ঘনত্ব কমে যায়। ফলে অ্যানিলিন দুর্বল ক্ষারধর্মী হয়। অর্থাৎ অ্যানিলিন দুর্বল ক্ষারক।
প্রশ্ন: ফিনাইল অ্যামিন বা অ্যানিলিন ডায়াজোনিয়াম লবণ গঠন করলেও মিথাইল অ্যামিন বা এলিফেটিক অ্যামিন ডায়াজোনিয়াম লবণ তৈরী করে না কেন?
অথবা, মিথাইল অ্যামিন ডায়াজোনিয়াম লবণ গঠন করে না কেন?
(Phenyl Amine or Aniline forms Diazonium salts but Methyl amines or Aliphatic amines do not form Diazonium Salts
OR, Methyl amine does not form diazonium salts)
উত্তর: অ্যালিফেটিক প্রাইমারী অ্যামিন যেমন- CH3NH2 ও নাইট্রাস এসিডের বিক্রিয়ায় “মধ্যক” রূপে অস্থায়ী অ্যালকাইল যেমন, মিথাইল ডায়াজোনিয়াম আয়ন (CH3 – N ≡ N) উৎপন্ন হয়। পরে এটি বিয়োজিত হয়ে N, গ্যাস ও কার্বোক্যাটায়ন যেমন, মিথাইল কার্বোনিয়াম আয়ন (CH3+) তৈরি করে। পরে দ্রবণে বিদ্যমান ঋণাত্মক আয়নের সাথে কার্বোক্যাটায়ন বা মিথাইল কার্বোনিয়াম আয়ন যুক্ত হয়ে অ্যালকোহল উৎপন্ন করে। যেমন-
H2O → H+ + OH-
CH3NH2 + H+→ CH3NH3+
CH3 – NH3+ HNO2 → CH3 – N = N + 2H2O
মিথাইল অ্যামোনিয়াম আয়ন
CH3 -N+ ≡N → CH3++ N2
C+H3+OH-→CH3OH
অপরদিকে বেনজিন ডায়াজোনিয়াম আয়ন (C6H5 – N ≡ N) অ্যালকাইল যেমন, মিথাইল ডায়াজোনিয়াম আয়ন (CH3- N≡ N) এর তুলনায় অধিকতর স্থিতিশীল । এর স্থিতিশীলতা লাভের কারণ হল বেনজিন বলয়ের পাই ইলেক্ট্রনের সাথে ডায়াজোমূলক (-N ≡ N)। এর অনুরণন বা রেজোন্যান্স গঠন, তা নিমের অরবিটাল চিত্র দ্বারা দেখানো হল-
চিত্র থেকে সুস্পষ্ট যে, এক্ষেত্রে C – N বন্ধনটি আংশিকভাবে দ্বিবন্ধনের বৈশিষ্ট্য লাভ করেছে। তাই অ্যারোমেটিক প্রাইমারী অ্যামিন ডায়াজোনিয়াম লবণ গঠন করে। কিন্তু অ্যালকাইল বা মিথাইল ডায়াজোনিয়াম (CH3 N2) আয়ন অস্থিতিশীল হওয়ায় অ্যালিফেটিক প্রাইমারী অ্যামিন যেমন- মিথাইল অ্যামিন ডায়াজোনিয়াম যৌগ তৈরি করে না। কারণ মিথাইল ডায়াজোনিয়াম আয়নে কোন অণুরণন ঘটে
প্রশ্ন: অ্যামিনো মূলক অর্থো-প্যারা নির্দেশক হলেও অ্যানিলিনের নাইট্রেশনকালে মেটা যৌগ উৎপন্ন হয় কেন? (Amino acid is ortho-para indicator, meta compounds are formed during the nitration of aniline)
উত্তর: প্রায়ই 60° -70°C তাপমাত্রায় অ্যামিলিনকে গাঢ় HNO3 এবং গাঢ় H2SO4 সহ উত্তপ্ত করলে মেটা নাইট্রো অ্যানিলিন উৎপন্ন হয়।
অ্যামিনো মূলক অর্থো-প্যারা নির্দেশক মূলক হলেও এক্ষেত্রে মেটা অবস্থানে নাইট্রেশন ঘটার কারণ হলো, নাইট্রেশনকালে অ্যানিলিনের সঙ্গে এসিডের বিক্রিয়ায় প্রথমে অ্যানিলিয়াম আয়ন (C6H5 – NH3) উৎপন্ন হয় যা পরে নাইট্রেশন বিক্রিয়ার মাধ্যমে নাইট্রো যৌগে পরিণত হয়। কিন্তু অ্যানিলিয়াম আয়নে N পরমাণু ধনাত্মক চার্জযুক্ত হওয়ায় তা নিষ্ক্রিয়কারী মূলকে পরিণত হয়। তাই মেটা নির্দেশক বিধায় এটি পরবর্তী ধাপে মেটা নাইট্রো অ্যানিলিন উৎপন্ন করে।
অ্যামিন (Amine)
টীকা লিখ
হফম্যান ডিগ্রেডেশন বা ক্ষুদ্রাংশকরণ বিক্রিয়া (Hofmann degradation or Minimization reaction):
অ্যালকাইল অ্যামাইড বা অ্যারাইল অ্যামাইডকে ব্রোমিন ও গাঢ় কষ্টিক সোডা দ্রবণ সহ উত্তপ্ত করলে প্রাইমারী অ্যালিফ্যাটিক বা অ্যারোমেটিক অ্যামিন উৎপন্ন হয়। এ পদ্ধতিতে উৎপন্ন অ্যামিনে মূল মাতৃযৌগ অ্যামাইড অপেক্ষা একটি কার্বন কম থাকে। তাই এ পদ্ধতিকে আবিষ্কারের নাম অনুসারে হফম্যান ক্ষুদ্রাংশকরণ বিক্রিয়া বলে।
R-CONH2 + Br2 + 4KOH > R-NH2 + 2KBr + K2CO3 + 2H20
উদাহরণ:
CH3 – CONH2+ Br2 + 4KOH→Ar –NH2 + 2KBr + K2CO3 + 2H2O
ইথান্যামাইড
আবার,
Ar -CONH2+ Br2 + 4KOH → Ar – NH2 + 2KBr + K2CO3 + 2H2O
উদাহরণ:
C6H5 – CONH2 + Br2 + 4KOH → C6H5 – NH2 + 2KBr + K2CO3 + 2H2O
বেনজামাইড
যুগল গঠন বা কাপলিং বিক্রিয়া (Pair formation or coupling reaction):
অ্যারোমেটিক ডায়াজোনিয়াম আয়নসমূহ যেমন, বেনজিন ডায়াজোনিয়াম আয়ন, (C6H5 – N≡ N) হল দুর্বল ইলেকট্রোফাইল । তাই ডায়াজোনিয়াম ক্যাটায়নসমূহ ফেনল ও অ্যারোমেটিক অ্যামিনের সক্রিয় নিউক্লিওফিলিক প্রান্ত যেমন, 4অবস্থানে আক্রমণ করে ডায়াজো মূলক (-N ≡ N) দ্বারা ফেনল অথবা প্রাইমারী অ্যামিনের বেনজিন বলয়ের সাথে যুক্ত হয়ে রঙিন অ্যাজো যৌগ গঠন করে। এরূপ বিক্রিয়াকে অ্যাজো কাপলিং বা অ্যাজো যুগল গঠন বিক্রিয়া বলে। এসব অ্যাজো কাপলিং দ্বারা ডায়াজোনিয়াম লবণ সনাক্ত করা যায়।
উদাহরণ:
(১) লঘু ক্ষারীয় দ্রবণে বেনজিন ডায়াজোনিয়াম ক্লোরাইডের সাথে ফেনলে বিক্রিয়া করলে দুটি বেনজিন বলয় ডায়াজোমূলক (-N ≡ N-) দ্বারা যুক্ত হয়ে কমলা বর্ণের প্যারা হাইড্রক্সি অ্যাজো বেনজিন গঠিত হয়।
(২) অতি লঘু অশ্লীয় দ্রবণে বেনজিন ডায়াজোনিয়াম ক্লোরাইডের সাথে অ্যানিলিন বিক্রিয়া করলে দুটি বেনজিন বলয় ডায়াজোমূলক (-N- N-) দ্বারা যুক্ত হয়ে হলুদ বর্ণের প্যারা অ্যামিনো অ্যাজো বেনজিন গঠিত হয়।
কাৰ্বিল অ্যামিন বিক্রিয়া (Carbylamine reaction):
ক্লোরোফরম ও অ্যালকোহলীয় KOH দ্রবণের সাথে প্রাইমারী অ্যালিফেটিক বা অ্যারোমেটিক অ্যামিনকে 60 -70°C তাপমাত্রায় উত্তপ্ত করলে উগ্র গন্ধযুক্ত আইসো সায়ানাইড বা কাৰ্বিল অ্যামিন উৎপন্ন হয়। এই বিক্রিয়াকে কাৰ্বিল অ্যামিন বিক্রিয়া বলা হয়।
CH3 – NH2 + CHCl3+ 3KOH ∆→ CH3 – NC + 3KCl + 3H2O
মিথাইল আইসো সায়ানাইড
C6H5 – NH2 + CHCl3 + 3KOH ∆→ C6H5 – NC + 3KCl + 3H2O
ফিনাইল আইসো সায়ানাইড
প্রশ্ন: কিরূপে ১° অ্যালিফেটিক বা অ্যারোমেটিক অ্যামিন সনাক্ত করা যায়? (Way to identify 1° Aliphatic or Aromatic Amine)
উত্তর: কাৰ্বিল অ্যামিন বিক্রিয়ার সাহায্যে ১° অ্যালিফেটিক অ্যামিন (মিথাইল অ্যামিন) এবং ১৭ অ্যারোমেটিক অ্যামিন (অ্যানিলিন) সনাক্ত করা যায়। ক্লোরোফরম ও অ্যালকোহলীয় KOH দ্রবনের সাথে প্রাইমারী
অ্যালফেটিক বা অ্যারোমেটিক অ্যামিনকে 60 -70°C তাপমাত্রায় উত্তপ্ত করলে উগ্র গন্ধযুক্ত আইসো সায়ানাইড বা কাৰ্বিল অ্যামিন উৎপন্ন হয়। এই বিক্রিয়াকে কাৰ্বিল অ্যামিন বিক্রিয়া বলা হয়।
CH3 – NH2 + CHCl3+ 3KOH ∆→ CH3 – NC + 3KCl + 3H2O
মিথাইল আইসো সায়ানাইড
C6H5 – NH2 + CHCl3 + 3KOH ∆→ C6H5 – NC + 3KCl + 3H2O
ফিনাইল আইসো সায়ানাইড
প্রশ্ন: ১° অ্যালিফেটিক অ্যামিন এবং ১° অ্যারোমেটিক অ্যামিনের মধ্যে কিরূপে পার্থক্য করা যায়? (Difference between 1° Aliphatic Amine and 1° Aromatic Amine)
উত্তর: হাইড্রোক্লোরিক এসিড দ্রবীভূত ১° অ্যারোমেটিক অ্যামিন বা অ্যানিলিন দ্রবণের তাপমাত্রাকে 0 – 5°C তাপমাত্রার নিচে নামিয়ে এর মধ্যে ধীরে ধীরে সোডিয়াম নাইট্রাইট (NaNO) দ্রবণ যোগ করলে বেনজিন ডায়াজোনিয়াম ক্লোরাইড উৎপন্ন হয়।
বেনজিন ডায়াজোনিয়াম ক্লোরাইড কিন্তু হাইড্রোক্লোরিক এসিডে দ্রবীভূত ১° অ্যালিফেটিক অ্যামিন বা মিথাইল অ্যামিনের দ্রবণে সোডিয়াম নাইট্রেট দ্রবণ যোগ করলে মিথাইল অ্যালকোহল উৎপন্ন হয়। এক্ষেত্রে ডায়াজোনিয়াম লবণ উৎপন্ন হয় না। কারণ অ্যালকাইল ডায়াজোনিয়াম আয়নের স্থিতিশীলতা নেই।
CH3- NH2 + HNO2NaNO2+HCl→ CH3 – OH + N2 + H2O
অ্যালডিহাইড (Aldehydes):
(-CHO) কার্যকরীমূলক বিশিষ্ট জৈব যৌগ যা হাইড্রোকার্বন, অ্যালকোহলের জারণ এবং জৈব এসিডের বিজারণের ফলে উৎপন্ন হয়। অ্যালকেনের একটি হাইড্রোজেন পরমাণু (—CHO) গ্রুপ দ্বারা প্রতিস্থাপিত হলে, তাদের অ্যালডিহাইড শ্রেণির যৌগ বলে । IUPAC অনুসারে অ্যালডিহাইড শ্রেণির যৌগের কার্যকরী মূলক -CHO । এদের নামের শেষে ‘অ্যাল’ কথাটি যুক্ত থাকে । অ্যালডিহাইডের সাধারণ সংকেত R—CHO, যেখান R হল অ্যালকিল মূলক, কেবলমাত্র প্রথম যৌগ ফরম্যালডিহাইড ( H—CHO ) এর ক্ষেত্রে R = H । যেমনঃ মিথান্যাল (H-CHO), ফরম্যালডিহাইড (H-CHO), ইথ্যানাল(CH -CHO), প্রোপিয়োন্যালহাইড বা প্রোপান্যাল [CH3CH2CHO], ইত্যাদি ।
কিটোন (Ketone):
যে সব জৈব যৌগে কিটোনিক গ্রুপ থাকে, তাদের কিটোন শ্রেণির যৌগ বলে । এই শ্রেণির যৌগের কার্যকরী মূলক [ > C = O ] , কার্বনের দুটি যোজ্যতাই কার্বন পরমাণু দ্বারা তৃপ্ত । এই যৌগে কার্যকরী মূলকের সঙ্গে দুটি অ্যালকিল মূলক ( ভিন্ন বা অভিন্ন ) যুক্ত থাকে । উদাহরণ:
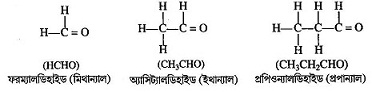
অ্যালডিহাইড ও কিটোনের মধ্যে পার্থক্যঃ
IUPAC অনুসারে অ্যালডিহাইড শ্রেণির যৌগের কার্যকরী মূলক -CHO । এদের নামের শেষে ‘অ্যাল’ কথাটি যুক্ত থাকে। অ্যালডিহাইড ও কিটোনের মধ্যে পার্থক্য নিম্নরূপ-
১. অ্যালডিহাইড টলেন বিকারকের সাথে বিক্রিয়া করে সিলভার দর্পণ গঠন করে । অন্যদিকে, কিটোন এ বিক্রিয়া করেনা ।
২. অ্যালডিহাইড ফেহলিং দ্রবণের সাথে বিক্রিয়া করে লাল অধঃক্ষেপ তৈরি করে । অন্যদিকে, কিটোন এ বিক্রিয়া করেনা ।
৩. অ্যালডিহাইড সিফস্ বিকারকের সাথে বিক্রিয়া করে গোলাপী বর্ণ ফিরিয়ে আনে। অন্যদিকে কিটোন বিক্রিয়া করেনা।
৪. অ্যালডিহাইড উত্তপ্ত NaOH এর সাথে বিক্রিয়া করে রেজিন গঠন করে । অন্যদিকে কিটোন রেজিন গঠন করে না ।
৫. অ্যালডিহাইড সহজেই পলিমার গঠন করে। অন্যদিকে, কিটোন পলিমার গঠন করে না।
methyl alcohol
acetylene
methane
ethyl formate
(কার্বক্সিলিক এসিড এবং এদের জাতক (Carboxylic acids and their derivatives))
প্রশ্ন: অ্যালিফ্যাটিক কার্বক্সিলিক এসিড প্রস্তুতির তিনটি সাধারণ প্রস্তুতি লিখ । (Three general preparations for the preparation of Aliphatic Carboxylic acids)
উত্তর:
(১) অ্যালকোহল হতে কার্বোক্সিলিক এসিড (Alcohol to Carboxylic acids): প্রাইমারী অ্যালকোহলকে সালফিউরিক এসিডযুক্ত K2Cr207 দ্বারা জারিত করা হলে অ্যালকোহলের সমসংখ্যক কার্বন পরমাণু বিশিষ্ট কার্বক্সিলিক এসিড উৎপন্ন হয়।
R-CH2-OH +OK2Cr207→ H2SO4 R- CHO+H2O
R-CHO + OR→COOH
উদাহরণ:
CH3- CH2 -OH + OK2Cr207→ CH3 – CHO + H2O
CH3 – CHO + O→ CH3-COOH
কার্বক্সিলিক এসিড
(২) অ্যালকাইল সায়ানাইড হতে কার্বক্সিলিক এসিড (Carboxylic acid from Alkyl cyanide): অ্যালকেন নাইট্রাইল বা অ্যালকাইল সায়ানাইডকে লঘু খনিজ এসিড। দ্রবণ সহযোগে আর্দ্র বিশ্লেষণ করলে কার্বক্সিলিক এসিড ও অ্যামোনিয়া উৎপন্ন হয়।
RX + KCN∆→R-CN + KX
R– CN + 2H2OHCl→ R-COOH + NH3
উদাহরণ:
CH3X + KCN ∆→ CH3 – CN + KX
CH3 – CN + 2H2O HCl→ CH3 -COOH + NH3
(৩) গ্রিগনার্ড বিকারক হতে কার্বক্সিলিক এসিড (Carboxylic acid from Grignard reagent): অনাদ্র কঠিন কার্বন ডাই অক্সাইড গ্রিগনার্ড বিকারক RMgX) যোগ করা হলে প্রথমে যুত যৌগ উৎপন্ন হয়। পরে উৎপন্ন যুত যৌগকে লঘু HCl সহযোগে আর্দ্র বিশ্লেষণ করা হলে কার্বক্সিলিক এসিড উৎপন্ন হয়।
R- Mg-X+0=C=0→ 0=C|R-0- MgxH2O→R-COOH + Mg(OH)X
উদাহরণ:
CH3- Mg-I+0=C=0→ 0-C|CH3-0- MglH2O→ >CH3COOH + Mg(OH)I
প্রশ্ন: ইথাইন হতে ইথানয়িক এসিডের শিল্পোৎপাদন পদ্ধতি লিখ। (Method of industrial production of Ethanoic Acid from Ethane)
উত্তর: অ্যাসিটিলিন হতে ইথানয়িক এসিড ও শিল্পক্ষেত্রে বর্তমানে বিশুদ্ধ অ্যাসিটিক এসিড উৎপাদন ইথাইন বা এসিটিলিন থেকে সংশ্লেষণ প্রণালীতে করা হয়। পেট্রোলিয়ামের তাপ বিয়োজন উৎপন্ন ইথাইন গ্যাসকে 60°C তাপমাত্রায় উত্তপ্ত 1% মারকিউরিক সালফেট এবং 20% H2SO4 এসিডের জলীয় দ্রবণে চালনা করা হয়। ফলে ইথান্যাল উৎপন্ন হয়।
HC≡ CH+H2O1% HgSo4, 20% H2SO4→6O ° CH3CHO
উৎপন্ন ইথান্যালকে মাঙ্গানাস এসিটেট প্রভাবকের উপস্থিতিতে বায়ুর অক্সিজেন দ্বারা জারিত করে ইথানয়িক এসিড উৎপন্ন করা হয়।
2CH3CHO + O2CH3COO2Mn,600C)→2CH3COOH
প্রশ্ন: ইথানয়িকের এসিড হতে ইথাননায়িল ক্লোরাইড বা এসিটাল ক্লোরাইড কিভাবে পাওয়া যায়। (How to get Ethanol chloride or Acetyl chloride from Ethanoic acid)
উত্তর: ইথানয়িক এসিড PCI3 বা PCl5 বা SOCl2 (থায়েনিল ক্লোরাইড) এর সাথে বিক্রিয়া করে এসিটাল ক্লোরাইড উৎপন্ন করে।
CH3COOH + PC13 → CH3COCl + H3PO3
এসিটাল ক্লোরাইড ফসফরাস এসিড
বা, CH3COOH + PCl5 → CH3COCI + POCl3 + HCI
ফসফরাস অক্সি ক্লোরাইড
বা, CH3COOH + SOCl2 → CH3COCl + SO4 + HCl.
প্রশ্ন: ইথানয়িক এসিড হতে এসিটামাইড বা ইথান্যামাইড কিরূপে পাওয়া যায়? (Acetamide or Ethanamide is derived from Ethanoic acid)
উত্তর: ইথানয়িক এসিড এবং অ্যামোনিয়াম কার্বনেটের মিশ্রণকে উত্তপ্ত করে প্রথমে অ্যামোনিয়াম এসিটেট উৎপন্ন করা হয়। উৎপন্ন অ্যামোনিয়াম লবণকে গ্লাসিয়াল এসিটিক এসিডসহ 100°C তাপমাত্রায় উত্তপ্ত করা হলে ইথান্যামাইড পাওয়া যায়।
CH3COOH + NH42CO3 ∆ → 2CH3COONH4 + CO2 + H2O
CH3COONH4 CH3COOH→ 1000C CH3CONH2 + H2O
ইথান্যামাইড
প্রশ্ন: ইথানয়িক এসিড হতে ইথানল কিরূপে পাওয়া যায়? (Ethanol is obtained from Ethanoic acid)
উত্তর: ইথানয়িক এসিডকে লিথিয়াম অ্যালুমিনিয়াম হাইড্রেক্সাইড (LiAlH4) দ্বারা বিজারিত করা হলে ইথানল পাওয়া যায়।
CH3COOH +4H LiAlH → dry ithar CH3CH2OH + H20
ইথানল
প্রশ্ন: ইথানয়িক এসিড হতে মিথেন কিরূপে পাওয়া যায়? (Ethanoic Acid to Methane)
উত্তর: ইথানয়িক এসিড বা সোডিয়াম ইথানয়েটকে সোডালাইমের সাথে উত্তপ্ত করা হলে ডিকার্বক্সিলেশন বিক্রিয়ার মাধ্যমে মিথেন পাওয়া যায়।
CH3COOH + 2NaOH.CaO∆→ CH4 + Na2CO3.CaO + H2O
বা, CH3COONa + NaOH.CaO ∆→ CH4+ Na2CO3.CaO
প্রশ্ন: ইথানয়িক এসিড হতে কিরূপে এসিটিক অ্যানহাইড্রাইড বা ইথানোয়িক অ্যানহাইড্রাইড পাওয়া যায়। (Acetic anhydride or Ethanoic anhydride from Ethanoic acid)
উত্তর: নিরুদক P205 সহ ইথানয়িক এসিডকে পাতন করা হলে দুই অণু ইথানয়িক এসিড থেকে এক অণু পানি অপসারিত হয়ে এসিটিক অ্যানহাইড্রাইড পাওয়া যায়।
2CH3COOHP205→∆ CH3CO2O + H2O
এসিটিক অ্যানহাইড্রাইড
অনুরূপে,
2RCOOH P205→ RCO2O + H2O
অ্যালকানয়িক অ্যানাহাইড্রাইড
প্রশ্ন: ইথানয়িক এসিড হতে কিরূপে ক্লেরো ইথানয়িক এসিড পাওয়া যায়? (Chloro Ethanic acid obtained from Ethanoic acid)
উত্তর: লোহিত ফসফরাসের উপস্থিতিতে ফুটন্ত ইথানয়িক এসিডে ক্লোরিন চালনা করা হলে ক্লোরো ইথানয়িক এসিড উৎপন্ন হয়।
2CH3COOH + Cl2 লাল P→ CH2CICOOH + HCI
ক্লোরো ইথানয়িক এসিড এর মধ্যে Cl2গ্যাস চালনা করা হলে ডাই ক্লোরো ইথানয়িক এসিড এবং ট্রাইক্লোরো ইথানয়িক এসিড উৎপন্ন হয়।
CH2Cl.COOH + Cl2লাল P→CHCI2.COOH + HCI
CHCl2.COOH + Cl2লাল P→CCI3.COOH + HCI
কার্বক্সিলিক এসিড (Carboxylic acid)
প্রশ্ন: গ্লেসিয়াল এসিটিক এসিড এবং ভিনেগার কী? (Glacial acetic acid and Vinegar)
উত্তর: গ্লেসিয়াল এসিটিক ও অনার্স ও 100% বিশুদ্ধ ইথানয়িক এসিড বা অ্যাসিটিক এসিডকে গ্নেসিয়াল ইথানয়িক এসিড বা অ্যাসিটিক এসিড বলে। এই বিশুদ্ধ ইথানয়িক এসিডকে শীতল করলে তা 17°C তাপমাত্রায় বরফের ন্যায় বর্ণহীন কেলাসরূপে. জমে উঠে। এজন্যই অনার্দ্র ও বিশুদ্ধ ইথানয়িক এসিডকে গ্লেসিয়াল ইথানয়িক এসিড বা অ্যাসিটিক এসিড বলা হয়।
ভিনেগার: এসিটিক এসিডের 6-10% জলীয় দ্রবণকে ভিনেগার বলে।
প্রস্তুতি: ইথাইল অ্যালকোহলের 10% জলীয় দ্রবণকে মাইকোডার্মা অ্যাসিটি নাম ব্যাকটেরিয়ার উপস্থিতিতে বায়ুর অক্সিজেন দ্বারা জারিত করে ভিনেগার প্রস্তুত করা হয়।
CH3 – CH2-OH (aq) +O2→ CH3-COOH(aq) + H2O
ব্যবহার: মাছ ও মাংসের সংরক্ষণে ভিনেগার নাম এসিটিক এসিড ব্যবহৃত হয়।
প্রশ্ন: মিথানয়িক এসিড ও ইথানয়িক এসিড এর মধ্যে পার্থক্য লিখ। (Difference between Methanoic Acid and Ethanoic Acid)
উত্তর:
| বিষয় | মিথানয়িক এসিড | ইথানয়িক এসিড |
| কার্যকরী মূলক | মিথানয়িক এসিডে এলডিহাইড এবং কার্বক্সিল উভয়মূলক বিদ্যমান। | ইথানয়িক এসিডে শুধু কার্বক্সিল মূলক বিদ্যমান। |
| টলেন বিকারক পরীক্ষা | টলেন বিকারক বিজারিত হয়। ফলে ধাতব সিলভারের কাল অধঃক্ষেপ বা সিলভার দর্পন উৎপন্ন হয়। H – COOH + 2AgNH32OH→ 2Ag↓+NH42CO3+2NH3+H2O | ইথানয়িক এসিড টলেন বিকারকের সাথে বিক্রিয়া দেখায়। উৎপন্ন হয় না। |
| ফেলিং দ্রবণ পরীক্ষা | ফেলিং দ্রবণকে বিজারিত করে কিউপ্রাস অক্সাইডের (Cu2 O) লাল বর্ণের অধঃক্ষেপ তৈরি করে। H – COOH + 2CuOH2 + 2NaOH → Cu2O↓ + Na2CO3 + 4H20 | কোন বিক্রিয়া দেখায় না। |
| অম্লত্ব | ইথানয়িক এসিডের তুলনায় 10 গুণ শক্তিশালী। এর pka = 3.74 | মিথানয়িক এসিড এর তুলনায়। দুর্বল। এর pka = 4.74 |
| H2SO4, নিরূদন। | এটি নিরুদিত হয়ে কার্বন মনোক্সাইড এবং পানি উৎপন্ন করে। HCOOH∆→ + CO+H20 | কোন নিরূদন ঘটে না। |
প্রশ্ন: বিভিন্ন প্রকার ফলের মধ্যে কি কি এস্টার আছে তা উল্লেখ কর। (Different types of Esters are present in different types of fruits)
উত্তর:
| নাম | উৎস |
| মিথাইল বিউটানোয়েট | আপেল |
| ইথাইল বিউটানোয়েট | আনারস |
| ৩-মিথাইল বিউটাইল ইথানয়েট (আইসোঅ্যামাইল অ্যাসিটেট) | নাশপাতি |
| অকটাইল ইথানোয়েট | কমলা |
| পেন্টাইল ইথানোয়েট (অ্যামাইল অ্যাসিটেট) | পাকা কলা |
| পেন্টাইল বিউটায়েট | স্ট্রবেরী |
| মিথাইল অ্যানথ্রানিলেট | আঙ্গুর |
প্রশ্ন: কার্বক্সিলিক এসিড এবং অ্যাসাইল ক্লোরাইডের মধ্যে কোনটির রাসায়নিক সক্রিয়তা বেশী- ব্যাখ্যা কর। (Which of the following is more chemically active than Carboxylic acid and acyl chloride?)
উত্তর: অ্যাসাইল ক্লোরাইড (RCOCl) সক্রিয়তা এর কার্যকরী মূলকের আংশিক ধণাত্মক চার্জযুক্ত কার্বন পরমাণুতে নিউক্লিওকাইলের আক্রমণের মাত্রার উপর নির্ভর করে। ROCl এবং RCOOH এর গঠন নিমরূপ-
ক্লোরিনের ঋণাত্মক আবেশ ধর্মের (-l) কারণে এর দিকে বন্ধনের ইলেক্ট্রন ঘনত্ব বৃদ্ধি পায়। ফলে কার্বক্সিল কার্বনের আংশিক ধণাত্মক চার্জ আরো বেড়ে যায় । কিন্তু কার্বক্সিলিক এসিডের বেলায় -OH মূলক থেকে ইলেক্ট্রন ঘনত্ব কার্বনিল মূলকের কার্বন পরমাণুর দিকে আকৃষ্ট হয়। আমরা জানি, যেখানে ধণাত্মক চার্জ বেশী হবে সেখানে নিউক্লিওফিলিক প্রতিস্থাপন বিক্রিয়া বেশী ঘটে। যেহেতু RCOCl এবং RCOOH এর মধ্যে RCOCl এর C পরমাণুতে ধণাত্মক চার্জের পরিমাণ বেশি তাই। অ্যাসাইল ক্লোরাইড এর সক্রিয়তা RCOOH এর তুলনায় বেশী।
প্রশ্ন: কার্বক্সিলিক মূলকের কার্বনিল মূলক ও হাইড্রক্সিল মূলক যথাক্রমে কার্বনাইল যৌগ ও অ্যালকোহলের বিক্রিয়া দেখায় না কেন? (Why carbonyl-based and hydroxyl-based carbonyl compounds and alcohols do not react)
উত্তর: কার্বক্সিল মূলক একটি কার্বনিল মূলক (C =O) ও একটি হাইড্রক্সিল (OH) মূলকের সমন্বয়ে গঠিত। যুক্ত অবস্থায় মূলকদ্বয় পরস্পরকে এমনভাবে প্রভাবিত করে যে, কার্বক্সিলিক এসিডসমূহ কখনও কার্বনিল বা অ্যালকোহলের সাদৃশ্যপূর্ণ বিক্রিয়া দেখায়। কার্বক্সিলিক এসিড মূলকের গাঠনিক সংকেত নিম্নরূপ-
কার্বক্সিল এসিড মূলকের পোলার কার্বনিল মূলক হাইড্রক্সিল মূলকের অক্সিজেন হতে ইলেক্ট্রন নিজের দিকে টেনে নেয়। ফলে কার্বক্সিল এসিডের 0 – H বন্ধনের H পরমাণু সহজে আয়নিত হতে পারে। ফলে RCOOH সমূহ এসিড ধর্ম প্রদর্শন করে। এরা ক্ষারের সাথে বিক্রিয়া করে লবণ উৎপন্ন করে এবং পানির সাথে যুক্ত হয়ে হাইড্রোনিয়াম আয়ন (H3O+) ও কার্বক্সিলেট আয়ন উৎপন্ন করে যা অ্যালকোহল প্রদর্শন করে না। অর্থাৎ on মূক প্রতিস্থাপিত না হয় ৬-আমন: হা: ৭৮ সদর প্রবণতা বাড়ে। অর্থাৎ OH মূলক প্রতিস্থাপিত না হয়ে O-H আয়নিত হয়ে দানের প্রবণতা বাড়ে।
আবার হাইড্রক্সিল মূলক হতে কার্বনাইল মূলকের দিকে ইলেক্ট্রন প্রবাহ কার্বনাইল মূলকের কার্বনাইল কার্বনে সৃষ্ট ধণাত্মব চার্জের পরিমাণকে হ্রাস করে। ফলে নিউক্লিওফাইল ঐ মূলকে কার্বনাইল যৌগের বেলায় (অ্যালডিহাইড বা কিটোন) যেভাবে আক্রমণ করতে পারে কার্বক্সিলিক এসিডের বেলায় অনুরূপ আক্রমণ করতে পারে না। তাই কার্বক্সিল এসিডসমূহ কার্বনিল যৌগসমূহের ন্যায় নিউক্লিওফিলিক যুত বিক্রিয়া দেখায় না।
উত্তর: কোন যৌগের অম্লত্ব নির্ভর করে ঐ যৌগ প্রোটন (H+) দানের প্রবণতার উপর। যে যৌগ যত বেশী প্রোটন দান করতে পারে ঐ যৌগ তত বেশী অম্লীয় হয়। কার্বক্সিলিক (RCOOH) এসিড অণুতে অনুরণের ফলে OH মূলকের 0 পরমাণু ধণাত্মক আধান হওয়ায় 0 – H বন্ধনের ইলেক্ট্রন জোড় H এর চেয়ে O এর অধিকতর নিকটে চলে আসে। ফলে O-H বন্ধন দুর্বল হয় এবং H+ দান করার প্রবণতা বৃদ্ধি পায়। ফলে কার্বক্সিলিক এসিড অশ্লধর্মী হয়। এর অণুরণন গঠন নিয়ে দেওয়া হল
R –CO- 0- ↔ R -C↿O- = 0
তাছাড়া RCOOH এসিড প্রোটন দান করার পর সৃষ্ট কার্বক্সিলেট আয়ন (RCOO-) অনুরণন সুস্থিত হয়। কারণ RCOO- আয়নের ঋণাত্মক চার্জ অণুরণনের মাধ্যমে সমভাবে উভয় অক্সিজেন পরমাণুর মধ্যে সমভাবে বণ্টন হয়। যা নিন্মে দেখানো হলো –
কিন্তু অ্যালকোহলের (R- OH) ক্ষেত্রে অনুরণন ঘটে না বলে -OH মূলক থেকে H+ বিমুক্ত করা কষ্টকর। তাছাড়া H+ দানের পর সৃষ্ট অ্যালকক্সাইড আয়ন অণুরণন সুস্থিত না হওয়ায় পশ্চাৎমুখী বিক্রিয়ার কারণে তা সহজে H’ দিতে পারে না। অর্থাৎ
R-OH ↔R -0-+ H+
তাই কার্বক্সিলিক এসিড অ্যালকোহল হতে শক্তিশালী এসিড।
কার্বক্সিলিক এসিড (Carboxylic acid)
প্রশ্ন: কার্বক্সিলিক মূলকের কার্বনিল মূলক ও হাইড্রক্সিল মূলক যথাক্রমে কার্বনাইল যৌগ ও অ্যালকোহলের বিক্রিয়া দেখায় না কেন? (Why carbonyl-based and hydroxyl-based carbonyl compounds and alcohols do not react)
উত্তর: কার্বক্সিল মূলক একটি কার্বনিল মূলক (C =O) ও একটি হাইড্রক্সিল (OH) মূলকের সমন্বয়ে গঠিত। যুক্ত অবস্থায় মূলকদ্বয় পরস্পরকে এমনভাবে প্রভাবিত করে যে, কার্বক্সিলিক এসিডসমূহ কখনও কার্বনিল বা অ্যালকোহলের সাদৃশ্যপূর্ণ বিক্রিয়া দেখায়। কার্বক্সিলিক এসিড মূলকের গাঠনিক সংকেত নিম্নরূপ-
কার্বক্সিল এসিড মূলকের পোলার কার্বনিল মূলক হাইড্রক্সিল মূলকের অক্সিজেন হতে ইলেক্ট্রন নিজের দিকে টেনে নেয়। ফলে কার্বক্সিল এসিডের 0 – H বন্ধনের H পরমাণু সহজে আয়নিত হতে পারে। ফলে RCOOH সমূহ এসিড ধর্ম প্রদর্শন করে। এরা ক্ষারের সাথে বিক্রিয়া করে লবণ উৎপন্ন করে এবং পানির সাথে যুক্ত হয়ে হাইড্রোনিয়াম আয়ন (H3O+) ও কার্বক্সিলেট আয়ন উৎপন্ন করে যা অ্যালকোহল প্রদর্শন করে না। অর্থাৎ on মূক প্রতিস্থাপিত না হয় ৬-আমন: হা: ৭৮ সদর প্রবণতা বাড়ে। অর্থাৎ OH মূলক প্রতিস্থাপিত না হয়ে O-H আয়নিত হয়ে দানের প্রবণতা বাড়ে।
আবার হাইড্রক্সিল মূলক হতে কার্বনাইল মূলকের দিকে ইলেক্ট্রন প্রবাহ কার্বনাইল মূলকের কার্বনাইল কার্বনে সৃষ্ট ধণাত্মব চার্জের পরিমাণকে হ্রাস করে। ফলে নিউক্লিওফাইল ঐ মূলকে কার্বনাইল যৌগের বেলায় (অ্যালডিহাইড বা কিটোন) যেভাবে আক্রমণ করতে পারে কার্বক্সিলিক এসিডের বেলায় অনুরূপ আক্রমণ করতে পারে না। তাই কার্বক্সিল এসিডসমূহ কার্বনিল যৌগসমূহের ন্যায় নিউক্লিওফিলিক যুত বিক্রিয়া দেখায় না।
উত্তর: কোন যৌগের অম্লত্ব নির্ভর করে ঐ যৌগ প্রোটন (H+) দানের প্রবণতার উপর। যে যৌগ যত বেশী প্রোটন দান করতে পারে ঐ যৌগ তত বেশী অম্লীয় হয়। কার্বক্সিলিক (RCOOH) এসিড অণুতে অনুরণের ফলে OH মূলকের 0 পরমাণু ধণাত্মক আধান হওয়ায় 0 – H বন্ধনের ইলেক্ট্রন জোড় H এর চেয়ে O এর অধিকতর নিকটে চলে আসে। ফলে O-H বন্ধন দুর্বল হয় এবং H+ দান করার প্রবণতা বৃদ্ধি পায়। ফলে কার্বক্সিলিক এসিড অশ্লধর্মী হয়। এর অণুরণন গঠন নিয়ে দেওয়া হল
R –CO- 0- ↔ R -C↿O- = 0
তাছাড়া RCOOH এসিড প্রোটন দান করার পর সৃষ্ট কার্বক্সিলেট আয়ন (RCOO-) অনুরণন সুস্থিত হয়। কারণ RCOO- আয়নের ঋণাত্মক চার্জ অণুরণনের মাধ্যমে সমভাবে উভয় অক্সিজেন পরমাণুর মধ্যে সমভাবে বণ্টন হয়। যা নিন্মে দেখানো হলো –
কিন্তু অ্যালকোহলের (R- OH) ক্ষেত্রে অনুরণন ঘটে না বলে -OH মূলক থেকে H+ বিমুক্ত করা কষ্টকর। তাছাড়া H+ দানের পর সৃষ্ট অ্যালকক্সাইড আয়ন অণুরণন সুস্থিত না হওয়ায় পশ্চাৎমুখী বিক্রিয়ার কারণে তা সহজে H’ দিতে পারে না। অর্থাৎ
R-OH ↔R -0-+ H+
তাই কার্বক্সিলিক এসিড অ্যালকোহল হতে শক্তিশালী এসিড।
প্রশ্ন: কার্বক্সিলিক এসিডসমূহের অধর্মের কারণ ব্যাখ্যা কর। (The cause of carboxylic acids)
উত্তর: কোন যৌগের অম্লত্ব নির্ভর করে ঐ যৌগ প্রোটন (H+) দানের প্রবণতার উপর। যে যৌগ যত বেশী প্রোটন দান করতে পারে ঐ যৌগ তত বেশী অশ্লীয় হয়। কার্বক্সিলিক (RCOOH) এসিড অণুতে অণুরণনের ফলে OH মূলকের 0 পরমাণু ধণাত্মক আধান হওয়ায় 0 – H বন্ধনের ইলেক্ট্রন জোড় H এর চেয়ে 0 এর অধিকতর নিকটে চলে আসে। ফলে 0- H বন্ধন দুর্বল হয় এবং H+ দান করার প্রবণতা বৃদ্ধি পায়। ফলে কার্বক্সিলিক এসিড অশ্লধর্মী হয়। এরা ক্ষারের সাথে বিক্রিয়া করে লবণ উৎপন্ন করে এবং পানির সাথে যুক্ত হয়ে হাইড্রোনিয়াম আয়ন (H3O+) ও কার্বক্সিলেট আয়ন উৎপন্ন করে।
R -CO – 0 – H + H20↔R – CO – 0-+ H3O+
অ্যালকানয়েট আয়ন এর অণুরণন গঠন নিমে দেওয়া হল-
R-CO- 0- ↔ R -CO-= 0
তাছাড়া RCOOH এসিড প্রোটন দান করার পর সৃষ্ট কার্বক্সিলেট আয়ন (RCOO-) অণুরণন সুস্থিত হয়। কারণ RCOO- আয়নের ঋণাত্মক চার্জ অণুরণের মাধ্যমে সমভাবে উভয় অক্সিজেন পরমাণুর মধ্যে সমভাবে বণ্টন হয়। যা নিয়ে দেখানো হলো-
প্রশ্ন: ফেনল এবং কার্বক্সিলিক এসিডের মধ্যে কিরূপে পার্থক্য করা যায়? (Difference between Phenol and Carboxylic acid)
উত্তর: ফেনল এবং কার্বক্সিলিক এসিড উভয়ে অম্লধর্মী যৌগ। তবে কার্বক্সিলিক এসিড কার্বনিক এসিড অপেক্ষা শক্তিশালী কারণ এটি NaHCO3 এর সাথে বিক্রিয়া করে বুদবুদ আকারে CO2 গ্যাস উৎপন্ন করে। যা চুনের পানিকে ঘোলাটে করে।
RCOOH + NaHCO3 → RCOONa + CO2 +H2O
CaOH2 + CO2→ CaCO3 + H2O
কিন্তু ফেনল কার্বনিক এসিড (H2CO3) অপেক্ষা দুর্বল হওয়ায় তা NaHCO3 এর সাথে বিক্রিয়া করে CO2 উৎপন্ন করে না ।
প্রশ্ন: কিরূপে কার্বক্সিল মূলক সনাক্ত করা যায়? (Way to identify Carboxyl group)
উত্তর: কার্বক্সিলিক এসিড NaHCO3 এর সাথে বিক্রিয়া করে CO2 উৎপন্ন করে যা চুনের পানি ঘোলাটে করে।
RCOOH + NaHCO3 → RCOONa + CO2 +H2O
CaOH2 CO2 → CaCO3 + H2O
কার্বক্সিলিক এসিডের জাতকসমূহের কতিপয় গুরুত্বপূর্ণ বিক্রিয়া
(Some important reactions of Derivative of carboxylic acis)
(ক) এসিড ক্লোরাইড (RCOCI) এর বিজারণ:
(i) রোজেনমুন্ড বিজারণ:
R-CO-Cl+H2Pd, BaSO4→R-CO-H+ HCl
উদাহরণ:
CH3-CO-Cl+H2Pd, BaSO4→CH3-CO-H+ HCl
(ii) তীব্র বিজারণ:
R-CO-Cl+4H LiAlH4→ শুল্ক ইথার R-CH2OH+HCl
উদাহরণ:
CH3-CO-Cl+4HLiAlH4→CH3CH2OH+HCl
প্রস্তুতি: R -CNH2O3→H+,H2O RCONH2
(খ) এসিড অ্যামাইড (RCONH2) এর বিক্রিয়া:
(i) P205 দ্বারা নিরুদন:
R-CO- NH2P2O5,∆→ R-C = N + H2O
উদাহরণ:
CH3 -CO – NH2, P2O5,∆→ CH3-C≡ N + H2O
(ii) নাইট্রাস এসিডের সাথে বিক্রিয়া :
RCONH2 +HNO2NaNO2+→HCL RCOOH + N2 + H20
উদাহরণ: CH3CONH2 +HNO2 CH3COOH + N2 + H20
(iii) হফম্যান ডিগ্রেডেশন বিক্রিয়া:
CH3CONH2 +Br2+4NaOH∆→ CH3NH2 + 2NaBr + Na2CO3+2H2O
(iv) বিজারণ:
RCONH2 +4HLiAlH4→ RCH2 – NH2 + H2O
উদা: CH3CONH2 + 4[H] CH3CH2NH2 + H2O
কার্বক্সিলিক এসিড (Carboxylic acid)
প্রশ্ন: কার্বক্সিলিক এসিডের স্ফুটনাংক সমআনবিক ভরের অ্যালকোহল অপেক্ষা বেশী কেন? (The boiling point of carboxylic acid is higher than that of alcohol of homogeneous mass)
উত্তর: কার্বক্সিলিক এসিডসমূহের অণুগুলো H-বন্ধন দ্বারা আবদ্ধ থাকে। বাষ্পীয় অবস্থায় এবং জৈব দ্রাবকে কার্বক্সিলিক এসিড ডাইমার গঠন করে।
যে সব জৈব এসিডের প্রতি অণুতে দুটি H-বন্ধন গঠনের সুবিধা আছে। তাদের স্ফুটনাংক সমআণবিক ভরের অ্যালকোহলের ফুটনাংক থেকে বেশী হয়।
প্রশ্ন: CH3COOH, CICH2COOH, CHCl2COOH এবং CCl3COOH এর অম্লত্বের ক্রম আলোচনা কর। (Order of H3COOH, CICH2COOH, CHCl2COOH And CCl3COOH)
উত্তর: যেসব যৌগ পরমাণু বা আয়ন পোটন (H+) দান সক্ষম তাদেরকে এসিড বলে। যে যৌগের H+ দানের প্রবণতা যত বেশী সেটি অধিক শক্তিশালী এসিড হয়।
প্রদত্ত যৌগ সমূহের মধ্যে CH3COOH এবং CICH2COOH এর গঠন হতে দেখা যায় CICH2-COOH এর কার্বনে একটি ইলেক্ট্রন আকর্ষী (ঋণাত্মক আবেশীয় ধর্ম) ক্লোরিন পরমাণু যুক্ত থাকে। ফলে Cl পরমাণু এর আকর্ষণে ইলেক্ট্রন Cl এর দিকে সরে যায় এবং আবেশিত ফলাফল জনিত কারণে কার্বনিল কার্বনের ধণাত্মকতা বেড়ে যাওয়ায় 0 – H বন্ধন দুর্বল হয়ে থাকে। ফলে (H) পরমাণু সহজে প্রোটন হিসেবে আলাদা হতে পারে। কিন্তু CHCOOH এ কার্বনিল কার্বনের সাথে একটি ইলেক্ট্রন দানকারী মূলক (ধণাত্মক আবেশীয় ধর্ম)-CH3 যুক্ত থাকায় কার্বনের ধণাত্মক চার্জ কিছুটা হ্রাস পায়। ফলে H+ ত্যাগের প্রবণতা CICH2COOH এর মতে সহজে হয় না।
আবার কার্বক্সিলেট এসিডের ৫-কার্বনে ইলেক্ট্রনগ্রাহী প্রতিস্থাপক (Cl) এর সংখ্যা যত বাড়ে উপরোক্ত কারণে অম্লত্বও তত বৃদ্ধি পায়। তাই প্রদত্ত যৌগসমূহকে তাদের অম্লত্বের বৃদ্ধির ক্রমানুসারে নিমরূপে সাজনো যায়।
CCl3 COOH > CHCI2COOH > CICH2COOH > CH 3COOH
pKa = 0.64 (pKa = 1.26) (pKa = 2.85) (pKa = 4.74)
প্রশ্ন: মিথানয়িক এসিড এবং ইথানয়িক এসিডের মধ্যে কোনটি অধিক শক্তিশালী ব্যাখ্যা কর।
উত্তর: মিথানয়িক এসিড (HCOOH) এবং ইথানয়িক এসিড (CH3COOH) এর গঠন নিমরূপ:
যে যৌগের প্রোটন দানের প্রবণতা যত বেশী সে যৌগ তত বেশী অম্লধর্মী হবে। উপরোক্ত দুই গঠন হতে দেখা যায় CH3COOH এর কার্বনিল কার্বনের সাথে একটি ইলেক্ট্রন দানকারী মূলক (ধণাত্মক আবেশীয় ধর্ম) -CH, যুক্ত আছে। ফলে কার্বনিল কার্বনের ধণাত্মক চার্জ কিছুটা হ্রাস পায়। ফলে H+ দান করার প্রবণতা কম। কিন্তু মিথানয়িক এসিডের কার্বনিল কার্বনের সাথে কোন ইলেক্ট্রন দানকারী মূলক যুক্ত না থাকায় এর কার্বনিল কার্বনের ধণাত্মক চার্জ বেড়ে যাওয়ায় 0-H বন্ধন থেকে ইলেক্ট্রন কার্বনিল কার্বনের দিকে ধাবিত হয়। ফলে O – H বন্ধন দুর্বল হয়ে থাকে। তাই H+ দানের প্রবণতা বেড়ে যায়।
প্রশ্ন: অ্যামাইডসমূহ অ্যামোনিয়ার তুলনায় দুর্বল ক্ষারধর্মী- ব্যাখ্যা কর। (Amides are weakly alkaline compared to ammonia)
উত্তর: প্রোটনীয় মতবাদ অনুসারে যেসব রাসায়নিক সত্ত্বা প্রোটন গ্রহণ করতে পারে তাদেরকে ক্ষার বলে। আবার লুইস মতবাদ মতে যে সব রাসায়নিক সত্ত্বা ইলেকট্রন জোড় দান করতে সক্ষম তাদেরকে ক্ষারক বলে। যার প্রোটন গ্রহণ ক্ষমতা অথবা ইলেক্ট্রন জোড় দান ক্ষমতা বেশী সেটি শক্তিশালী ক্ষারক হবে। অ্যামাইড এবং অ্যামোনিয়ার গঠন নিম্নরূপ-
অ্যামাইডের N পরমাণুতে নি:সঙ্গ ইস্ট্রেন যুগল থাকায় এরা ক্ষারকরূপে আচরণ করে, কিন্তু এ নি:সঙ্গ ইলেক্ট্রন যুগল অ্যামাইডমূলকে সঞ্চারণশীল থাকে বলে তা প্রোটনের জন্য সহজলভ্য নয়। অ্যামাইডের অণুরণন গঠন নিম্নে দেয়া হল-
কিন্তু NH3 তে এ ধরনের কোন অণুরণন না ঘটায় এর N- পরমাণু সহজে প্রোটন গ্রহণ করতে পারে। অর্থাৎ এক্ষেত্রে ইলেক্ট্রন জোড়ের দানের প্রবণতা বেশী বলেই NH3এর ক্ষারকত্ব বেশী। ক্ষারকত্ব N এর ইলেক্ট্রন প্রাপ্যতার উপর নির্ভর করে বলেই অ্যামাইডের ক্ষারকত্ব অ্যামোনিয়া অপেক্ষা কম।
প্রশ্ন: “মিথানয়িক এসিডের এসিড ও বিজারণ ধর্ম আছে”- ব্যাখ্যা কর। (Methanoic acid has acid and reduction properties)
উত্তর: মিথানয়িক (HCOOH) এসিডের গঠন নিম্নরূপ-
উপরের গঠন হতে দেখা যায় HCOOH এসিডে অ্যালডিহাইড এবং কার্বক্সিল মূলক আছে। এ মূলক সমূহের উপস্থিতিতে নিমের পরীক্ষা দ্বারা বুঝা যায়-
(i) অ্যালডিহাইড মূলকের বিজারণ ধর্ম আছে। যেহেতু HCOOH এ অ্যালডিহাইড মূলক আছে সেহেতু HCOOH বিজারণ ধর্ম দেখায়। যেমন-
(ক) HCOOH এসিড ফেলিং দ্রবণে চালনা করা হলে HCOOH ফেলিং দ্রবণকে বিজারিত লাল বর্ণের কিউপ্রাস অক্সাইড (Cu2O) এর অধঃক্ষেপ পড়ে।
HCOOH + 2CuOH2 + 2NaOH → Cu0+ HQ0+ NapCO3
(খ) HCOOH এসিড টলেন বিকারক দ্রবণে চালনা করা হলে HCOOH এসিড টলেন বিকারককে বিজারিত করে সিলভার দর্পন উৎপন্ন করে।
HCOOH + 2AgNH32OH→ NH42CO3 + 2H2O + 2Ag + 2NH3
iiHCOOH এর এসিড ধর্ম: নিমোক্ত বিক্রিয়া হতে HCOOH এর অম্ল ধর্ম প্রকাশ পায়।
মিথানয়িক এসিড ধাতুর সাথে বিক্রিয়া করে হাইড্রোজেন গ্যাস উৎপন্ন করে।
2HCOOH + Mg → HCOO2,Mg + H2
মিথানয়িক এসিড় ক্ষারের সাথে বিক্রিয়া করে লবণ ও পানি উৎপন্ন করে।
HCOOH + NaOH → HCOONa + H2O
মিথানয়িক এসিড সোডিয়াম বাই কার্বনেটের সাথে বিক্রিয়া করে বুদবুদ আকারে কার্বন ডাই অক্সাইড গ্যাস উৎপন্ন করে।
HCOOH + NaHCO3 + HCOONa+ CO2 + H2O
প্রশ্ন: গ্লিসারিন প্রস্তুতির একটি পদ্ধতি লিখ। (A method of preparation of glycerin)
উত্তর : তেল বা চর্বিকে ক্ষারীয় আর্দ্র বিশ্লেষণ করে সাবান প্রস্তুত করার প্রক্রিয়াকে সাবানায়ন বা স্যাপোনিফিকেশন বলে । এসময় উপজাত হিসেবে গ্লিসারিন পাওয়া যায় ।
প্রশ্ন: কিরূপে গ্লিসারিন সনাক্ত করা যায়। (Glycerin detection)
উত্তর: গ্লিসারিনকে নিরুদক KHSO4 বা P2O5 সহ উত্তপ্ত করলে এক অণু গ্লিসারিন হতে দুই অণু পানি অপসারিত হয়ে বিশ্রী গন্ধযুক্ত অ্যাক্রোলিন উৎপন্ন হয়। একে অ্যাক্রোলিন পরীক্ষা বলে।
প্রশ্ন: ডেটল কী? এর সংযুক্তি উল্লেখ কর। (Dettol and it’s composition)
উত্তর: ডেটল হল একটি বাণিজ্যিক নাম, যা অ্যান্টিসেপটিক এবং পরিষ্কারক কাজে ব্যবহৃত হয়। এর সংযুক্তিগুলো নিমরূপ।
১. 4.8% ক্লোরোজাইলিনল । এটি ডেটলের প্রধান উপাদান যা এন্টিসেপ্টিক এবং সংক্রামকরোধী ও পচন নিবারক হিসেবে কাজ করে ।
২. আইসোপ্রোপানল 40% । এটি অন্যান্য জীবাণু ধ্বংস করে।
৩. 10 – 15% পাইন অয়েল। এটি দ্রাবক হিসেবে কাজ করে, এটিতে ক্লোরোজাইলিনল দ্রবীভূত হয়।
৪. 70 – 75% সাবান পানি। এটি পরিস্কারক হিসেবে কাজ করে।
এটি পানিতে খুব কম পরিমাণ দ্রবীভূত হয়। এর দ্রাব্যতা হল 330mgL-1
প্রশ্ন: নাইট্রোগ্লিসারিন প্রস্তুতির একটি পদ্ধতি লিখ। (A method of preparation of nitroglycerin)
উত্তর: একটি গোলতলী ফ্লাক্সের মধ্যে 7ml ধূমায়িত H2SO4 এবং 9ml HNO3 এসিড বা নির্দিষ্ট অনুপাতে নিয়ে বরফ শীতল পানিতে শীতল করা হয়। অত:পর এ অবস্থায় ফ্লাক্সের মধ্যে প্রায় 20ml গ্লিসারিনকে ফোটায় যোগ করা হয়। মিশ্রণকে স্থির অবস্থায় তাপমাত্রা 30°C এর নীচে নিয়ন্ত্রণ করে প্রায় 30 মিনিটকাল রেখে দেওযা হয় ফলে নাইট্রোগ্লিসারিন উৎপন্ন হয়।
পৃথকীকরণ: গোলতলী ফ্লাক্সের উৎপন্ন নাইট্রোগ্লিসারিনসহ মিশ্রণকে পৃথকীকরণ ফানেলের সাহায্যে নাইট্রোগ্লিসারিনের স্তরকে পৃথক করে নেওয়া হয়। অত:পর তাকে 15°C তাপমাত্রার নিচে সংরক্ষণ করা হয়।
এস্টার কী?
এস্টার হলো জৈব যৌগের একটি শ্রেণি যা সাধারণত একটি কার্বক্সিলিক অ্যাসিড এবং একটি অ্যালকোহলের প্রতিক্রিয়ার মাধ্যমে তৈরি হয়। এর সাধারণ গঠন হলো \( RCOOR' \), যেখানে \( R \) এবং \( R' \) হলো অ্যালকাইল বা আরিল গ্রুপ।
এস্টারের বৈশিষ্ট্য
এস্টার তৈরির প্রক্রিয়া
এস্টার সাধারণত এস্টারিফিকেশন নামে পরিচিত একটি প্রতিক্রিয়া মাধ্যমে তৈরি হয়। এটি একটি রসায়ন প্রক্রিয়া যেখানে একটি কার্বক্সিলিক অ্যাসিড এবং একটি অ্যালকোহল একত্রে গরম করার মাধ্যমে পানির মুক্তি ঘটে। উদাহরণ:
\[
CH_3COOH + C_2H_5OH \rightarrow CH_3COOC_2H_5 + H_2O
\]
ব্যবহার
সারাংশ
এস্টার হলো জৈব রসায়নের একটি গুরুত্বপূর্ণ যৌগ যা বিভিন্ন শিল্প ও দৈনন্দিন জীবনে ব্যবহার হয়। এর মিষ্টি গন্ধ এবং রাসায়নিক বৈশিষ্ট্য একে খাদ্য, প্রসাধনী এবং শিল্পে অপরিহার্য করে তুলেছে।
| প্রকার | সাধারণ গঠন | উদাহরণ |
|---|---|---|
| প্রাথমিক অ্যামাইড | \( RCONH_2 \) | অ্যাসিটামাইড |
| দ্বিতীয়িক অ্যামাইড | \( RCONHR' \) | N-মিথাইল অ্যাসিটামাইড |
| তৃতীয়িক অ্যামাইড | \( RCONR'_2 \) | N, N-ডাইমিথাইল অ্যাসিটামাইড |
অ্যামাইড রাসায়নিক ও জৈবিক ক্ষেত্রে বিশেষভাবে গুরুত্বপূর্ণ।
কার্যকরী মূলক (Functional Group) হলো জৈব যৌগের নির্দিষ্ট অংশ যা যৌগের রাসায়নিক ও ভৌত বৈশিষ্ট্য নির্ধারণ করে। এটি জৈব যৌগের শনাক্তকরণ এবং শ্রেণিকরণের মূল উপাদান।
কার্যকরী মূলকের উপস্থিতি শনাক্তকরণ বিভিন্ন রাসায়নিক পরীক্ষার মাধ্যমে সহজে সম্পন্ন করা যায়। প্রতিটি কার্যকরী মূলকের জন্য নির্দিষ্ট বৈশিষ্ট্য এবং পরীক্ষার ফলাফল নির্ধারণ করা জৈব যৌগের শ্রেণিকরণে সহায়ক।
ইনফ্রারেড (IR) স্পেকট্রোস্কপি রাসায়নিক যৌগে বিদ্যমান বিভিন্ন কার্যকরী মূলকের শনাক্তকরণের একটি শক্তিশালী পদ্ধতি। অ্যালকোহল এবং কার্বক্সিলিক অ্যাসিডের কার্যকরী মূলকগুলো নির্দিষ্ট শোষণ ব্যান্ডের মাধ্যমে সহজেই চিহ্নিত করা যায়।
১. O-H স্ট্রেচিং (Broad Stretch):
অ্যালকোহল গ্রুপে হাইড্রোজেন বন্ডিংয়ের কারণে ৩২০০–৩৬০০ সেমি⁻¹ (cm⁻¹) রেঞ্জে একটি প্রশস্ত (broad) শোষণ ব্যান্ড পাওয়া যায়। এটি সাধারণত মসৃণ বা গোলাকার প্রকৃতির হয়।
উদাহরণ: ইথানল, মিথানল।
২. C-O স্ট্রেচিং:
অ্যালকোহলে C-O বন্ধনের জন্য ১০৫০–১১৫০ সেমি⁻¹ রেঞ্জে একটি মাঝারি (medium) ইন্টেনসিটির শোষণ ব্যান্ড দেখা যায়।
১. O-H স্ট্রেচিং (Very Broad):
কার্বক্সিলিক অ্যাসিডের O-H স্ট্রেচিং ব্যান্ড সাধারণত ২৫০০–৩৩০০ সেমি⁻¹ রেঞ্জে অত্যন্ত প্রশস্ত (very broad) হয়। এটি হাইড্রোজেন বন্ডিংয়ের কারণে বিস্তৃত প্রকৃতির।
২. C=O স্ট্রেচিং:
কার্বক্সিলিক অ্যাসিডের কার্বনাইল (C=O) গ্রুপের জন্য ১৬৯০–১৭৫০ সেমি⁻¹ রেঞ্জে একটি শক্তিশালী এবং ধারালো (sharp) শোষণ ব্যান্ড পাওয়া যায়।
৩. C-O স্ট্রেচিং:
১০০০–১৩০০ সেমি⁻¹ রেঞ্জে C-O স্ট্রেচিংয়ের জন্য একটি মাঝারি শোষণ ব্যান্ড উপস্থিত থাকে।
| কার্যকরী মূলক | প্রধান ব্যান্ড (সেমি⁻¹) | বৈশিষ্ট্য |
|---|---|---|
| অ্যালকোহল | ৩২০০–৩৬০০ (O-H), ১০৫০–১১৫০ (C-O) | প্রশস্ত, মসৃণ O-H স্ট্রেচিং |
| কার্বক্সিলিক অ্যাসিড | ২৫০০–৩৩০০ (O-H), ১৬৯০–১৭৫০ (C=O) | অত্যন্ত প্রশস্ত O-H এবং ধারালো C=O |
IR স্পেকট্রোস্কপিতে অ্যালকোহল এবং কার্বক্সিলিক অ্যাসিডের O-H এবং C=O ব্যান্ড তাদের শনাক্তকরণের জন্য নির্ভরযোগ্য সূচক। অ্যালকোহল ব্যান্ড মসৃণ ও প্রশস্ত হয়, আর কার্বক্সিলিক অ্যাসিডের O-H ব্যান্ড আরও প্রশস্ত এবং C=O ব্যান্ড ধারালো হয়।
বেনজিন সালফোনিক অ্যাসিডকে জারণের মাধ্যমে ফেনলে রূপান্তর করা হয়। এটি ফেনল প্রস্তুতির একটি সাধারণ পদ্ধতি।
প্রক্রিয়া:
\[ C_6H_6 + H_2SO_4 → C_6H_5SO_3H \]
\[ C_6H_5SO_3H + NaOH → C_6H_5ONa + H_2O \]
\[ C_6H_5ONa + HCl → C_6H_5OH + NaCl \]
(ফেনল উৎপন্ন হয়।)
কিউমিনকে (আইসোপ্রোপাইল বেনজিন) অক্সিডেশন ও হাইড্রোলাইসিসের মাধ্যমে ফেনলে রূপান্তর করা হয়।
প্রক্রিয়া:
\[ C_6H_5CH(CH_3)_2 + O_2 → C_6H_5C(CH_3)_2OOH \]
\[ C_6H_5C(CH_3)_2OOH → C_6H_5OH + (CH_3)_2CO \]
(অ্যাসিটোন এবং ফেনল তৈরি হয়।)
ক্লোরোবেঞ্জিনকে NaOH ও উচ্চ তাপমাত্রায় জারণের মাধ্যমে ফেনল প্রস্তুত করা যায়।
প্রক্রিয়া:
\[ C_6H_5Cl + NaOH →(300^\circ C, 300 atm)→ C_6H_5OH + NaCl \]
বেনজিন ডাইঅজোনিয়াম সল্টকে হাইড্রোলাইসিসের মাধ্যমে ফেনলে রূপান্তর করা হয়।
প্রক্রিয়া:
\[ C_6H_5N_2^+Cl^- + H_2O → C_6H_5OH + N_2 + HCl \]
বেনজিন সালফোনিক অ্যাসিডকে ক্ষার দিয়ে জারণের মাধ্যমে ফেনলে রূপান্তর করা হয়।
প্রক্রিয়া:
\[ C_6H_5SO_3H + NaOH → C_6H_5ONa + H_2O \]
\[ C_6H_5ONa + HCl → C_6H_5OH + NaCl \]
এই আলোচনা ফেনল প্রস্তুতির বিভিন্ন পদ্ধতির মূলধারাগুলোকে তুলে ধরেছে, যা শিল্প ও পরীক্ষাগারে ব্যাপকভাবে ব্যবহৃত হয়।
ব্যাকেলাইট
মেলাডুব
সেরুসাইট
ফরমিকা
নাইট্রো গ্লিসারিনের রাসায়নিক সূত্র: \(\text{C}_3\text{H}_5(\text{NO}_3)_3\)। এটি একটি নাইট্রেট এস্টার।
নাইট্রো গ্লিসারিন সাধারণত গ্লিসারিন এবং নাইট্রিক অ্যাসিডের বিক্রিয়ার মাধ্যমে প্রস্তুত করা হয়।
প্রতিক্রিয়া সমীকরণ:
\[
\text{C}_3\text{H}_5(\text{OH})_3 + 3\text{HNO}_3 \rightarrow \text{C}_3\text{H}_5(\text{NO}_3)_3 + 3\text{H}_2\text{O}
\]
এটি সাধারণত সালফিউরিক অ্যাসিডের উপস্থিতিতে পরিচালিত হয়।
টিএনটির রাসায়নিক সূত্র: \(\text{C}_7\text{H}_5\text{N}_3\text{O}_6\)। এটি একটি অ্যারোম্যাটিক নাইট্রোকম্পাউন্ড।
টলুইনকে নাইট্রিক অ্যাসিড ও সালফিউরিক অ্যাসিডের মিশ্রণের সাথে বিক্রিয়া ঘটিয়ে টিএনটি প্রস্তুত করা হয়।
প্রতিক্রিয়া ধাপসমূহ:
সারাংশ:
নাইট্রো গ্লিসারিন এবং টিএনটি উভয়ই শক্তিশালী বিস্ফোরক। নাইট্রো গ্লিসারিন তাপ ও আঘাতে অতি সংবেদনশীল, যেখানে টিএনটি তুলনামূলকভাবে স্থিতিশীল এবং সামরিক ক্ষেত্রে বেশি ব্যবহৃত হয়।
টিএনটি বা 2,4,6-ট্রাই নাইট্রোটলুইন একটি সুপরিচিত রাসায়নিক বিস্ফোরক। এটি নাইট্রেশন প্রক্রিয়ার মাধ্যমে টলুইন থেকে তৈরি হয় এবং এর রাসায়নিক সংকেত C₇H₅N₃O₆।
ডেটলের এর মূল উপাদান 4-ক্লোরো-3, 5-ডাইমিথাইল ফেনল। এর অপর নাম ক্লোরোজাইলিনল। ডেটলের সংকেত-
ডেটলের মূল উপাদান ক্লোরোজাইলিনল প্রস্তুতি : বেনজিন ডায়াজোনিয়াম ক্লোরাইডকে শুষ্ক AICI3 এর উপস্থিতিতে CH3I সহ ফ্রিডেল ক্রাফট অ্যালকাইলেশন ঘটালে 3, 5 – ডাই মিথাইল বেনজিন ডায়াজোনিয়াম ক্লোরাইড উৎপন্ন হয়। পরে উৎপন্ন যৌগকে লঘু HCI দ্রবণসহ 40°C তাপমাত্রায় উত্তপ্ত করলে অর্দ্র বিশ্লেষণ প্রক্রিয়ায় 3,5 – ডাইমিথাইল ফেনল উৎপন্ন হয় । উৎপন্ন ফেনলকে Fe প্রভাবকের উপস্থিতিতে ক্লোরিনেশন করলে 4-ক্লোরো-3, 5-ডাইমিথাইল ফেনল উৎপন্ন হয়।
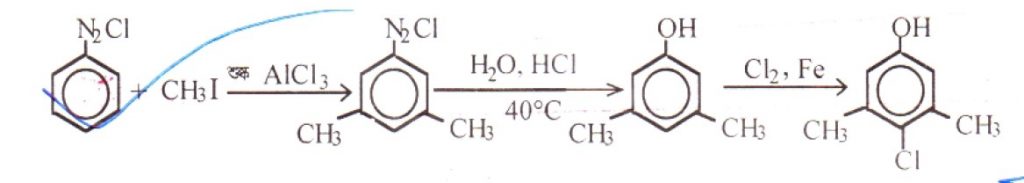
4-ক্লোরো-3, 5-ডাইমিথাইল ফেনল।
ডেটল হল শক্তিশালী জীবানুনাশক ও পচনরোধক। এর লঘু দ্রবণ জীবানুনাশক ও পচনরোধক হিসেবে ব্যবহৃত হয়।
প্যারাসিটামল প্রস্তুতির প্রাথমিক উপাদান
প্রস্তুতির রাসায়নিক প্রক্রিয়া
প্যারাসিটামল প্রস্তুতিতে সাধারণত নিম্নলিখিত ধাপগুলো অনুসরণ করা হয়:
প্রতিক্রিয়ার শুরু:
প্যারাএমিনোফেনল এবং অ্যাসিটিক অ্যানহাইড্রাইড মিশ্রিত করা হয়।
প্রতিক্রিয়ার সময় প্যারাএমিনোফেনল অ্যাসিটাইলেশন প্রক্রিয়ায় প্যারাসিটামল তৈরি করে।
রাসায়নিক সমীকরণ:
\[
C_6H_7NO + (CH_3CO)_2O \rightarrow C_8H_9NO_2 + CH_3COOH
\]
ব্যবহারিক লক্ষ্য
প্যারাসিটামল প্রস্তুতি রসায়নশাস্ত্র এবং ফার্মাসিউটিক্যাল ইন্ডাস্ট্রিতে একটি গুরুত্বপূর্ণ উদাহরণ। এটি বিভিন্ন জ্বর এবং ব্যথা উপশমে ব্যবহৃত হয়।
গলনাঙ্ক (Melting Point) একটি কঠিন পদার্থের নির্দিষ্ট তাপমাত্রা, যেখানে এটি তরলে রূপান্তরিত হয়। এটি জৈব যৌগের বিশুদ্ধতা নির্ধারণে একটি গুরুত্বপূর্ণ উপায়।
স্ফুটনাঙ্ক (Boiling Point) একটি তরলের সেই নির্দিষ্ট তাপমাত্রা, যেখানে এর বাষ্প চাপ বায়ুমণ্ডলীয় চাপের সমান হয়। এটি তরল জৈব যৌগের বিশুদ্ধতা ও শনাক্তকরণের জন্য ব্যবহৃত হয়।
গলনাঙ্ক এবং স্ফুটনাঙ্ক জৈব যৌগের বিশুদ্ধতা ও শনাক্তকরণের জন্য দুটি অত্যন্ত কার্যকরী পদ্ধতি। এগুলো বিশুদ্ধতার মান নির্ধারণ এবং যৌগগুলোর সঠিক শনাক্তকরণে গুরুত্বপূর্ণ ভূমিকা রাখে।
-196 C
196 C
100 C
-111 C
প্রশ্ন: প্লাস্টিসিটি কী? সব পলিমার প্লাস্টিক নয় অথচ সব প্লস্টিক পলিমার কেন? (Plasticity and Not all polymers are plastic but why all plastic polymers)
উত্তরঃ প্লাস্টিসিটি ও Plastic হলো পলিমার এর একটি রূপ। যেসব পলিমারকে তাপ দিলে তা নমনীয় হয় এবং চাপ দিয়ে বিভিন্ন আকৃতি দেয়া যায় তারই নাম প্লাস্টিক। আর প্লাস্টিক দ্রব্যের বৈশিষ্ট্যকেই বলা হয় প্লাস্টিসিটি। অর্থাৎ কোন পলিমারীয় দ্রব্যকে তাপ প্রয়োগে নমনীয় করে এর flexibility, প্রক্রিয়াকরণ এবং আকৃতি প্রদান যোগ্যতা বৃদ্ধি করার গুণাবলিকেই বলা হয় প্লাস্টিসিটি ।
বস্তুত সব পলিমারই প্লাস্টিক নয়। কারণ সাধারণত একটি পলিমারের দীর্ঘ চেইনের বিভিন্ন অংশের (segment) মধ্যে উচ্চ আর্কষণ বল বিরাজ করে যার কারণে পলিমার চেইনের অংশগুলোর নড়াচড়া (mobility) বন্ধ হয়ে যায়। ফলে পলিমারের কাঠামো কঠিন হয়ে যায়। এ কারণে পলিমার ভঙ্গুর হয়, বিশেষ করে নিম্ন তাপমাত্রায়।
যেমন- একটি রাবার বল –70°C এর নিচে শীতল করার পর যদি একে মেঝেতে ফেলে দেয়া হয় তাহলে বলটি ভেঙ্গে কাঁচের মত টুকরা টুকরা হয়ে গেছে। এ বিষয়টির নাম ভঙ্গুরতা (brittleness)। এ তাপমাত্রাটি যার নিচে প্লাস্টিক ভঙ্গুরতা অর্থাৎ glassy কাঠামো লাভ করে এবং যে তাপমাত্রার উপর এটির ভঙ্গুরতা লোপ পেয়ে নমনীয় ও আকৃতি প্রদানযোগ্য হয় তবে গলেনা (গলন তাপমাত্রার নাম Tm) Glass transition temperature (Tg)
খুবই কম আণবিক ভরবিশিষ্ট পলিমারকে টার পলিমার (Tar polymer), কম আণবিক ভরবিশিষ্ট পলিমারকে অলিগোমার (Oligomer), উচ্চ আণবিক ভরবিশিষ্ট পলিমারকে উচ্চ পলিমার (High polymer) এবং অতি উচ্চ আণবিক ভরবিশিষ্ট পলিমারকে আলট্রা অই পলিমার (Ultra high polymer) বলা হয়ে থাকে ।
পলিমারের শ্রেণিবিভাগ: (Classification of Polymer): উৎসের উপর ভিত্তি করে পলিমারকে তিন ভাগে করা হয়ে থাকে।
(ক) প্রাকৃতিক পলিমার,
(খ) কৃত্রিম পলিমার,
(গ) অকৃত্রিম পলিমার।
(ক) প্রাকৃতিক পলিমার: (Natural Polymer): সাধারণভাবে প্রকৃতি অর্থাৎ উদ্ভিদ ও প্রাণী থেকে প্রাপ্ত পলিমার এ জাতীয় পলিমার । যেমন- প্রাকৃতিক রাবার, স্টার্চ, সেলুলোজ ইত্যাদি।
(খ) কৃত্রিম পলিমার: (Synthetic polymer) : পরীক্ষাগারে কৃত্রিমভাবে প্রস্তুতকৃত পলিমারসমূহ এ জাতীয় পলিমার। যেমন- পলিইথিলিন, পলিস্ট্যারিন, পলিভিনাইল ক্লোরাইড, নাইলন, টেরিলিন ইত্যাদি।
(গ) অর্ধকৃত্রিম: (Semi-artificial): প্রাকৃতিক পলিমারকে বিভিন্ন রাসায়নিক প্রক্রিয়ার মাধ্যমে পরিবর্তিত করে এ জাতীয় পলিমার উৎপন্ন করা হয়ে থাকে। যেমন- হাইড্রোজেনেটেড প্রাকৃতিক রাবার, হ্যালোজেনেটেড প্রাকৃতির রাবার, সেলুলোজ অ্যাসিটেট, সেলুলোজ নাইট্রেট ইত্যাদি।
প্রয়োগের দিক থেকে বিবেচনা করলে পলিমারকে তিনটি শ্রেণীতে ভাগ করা হয়ে থাকে। যথা-
(ক) রবার (Rubber): সাধারণ অবস্থায় এদের উপর টান বা পীড়ন (strees) প্রয়োগ করলে এদের আকারের বিকতি ঘটে কিন্তু টান বা পীড়ন সরিয়ে নিলে পুনরায় পূর্বের আকার বা অবস্থায় ফিরে আসে। যেমন- প্রাকৃতিক রবার পলিবিউটাডাইইন রবার জাতীয় পলিমার অনিয়তাকার ও উচ্চ আণবিক ভর সম্পন্ন হয়। এরে প্রসারণশীলতা ও টানশক্তির মান খুবই উচ্চ এবং এ মান 300 psi হতে 3000 psi পর্যন্ত হয়ে থাকে ।
(খ) পাস্টিক (Plastic) : পলিমারের উপর টান বা পীড়ন প্রয়োগের ফলে যেসব পলিমারের আকারের স্থায়ী পরিবর্তন ঘটে তাদের পাস্টিক বলা হয়ে থাকে। প্লাস্টিক জাতীয় পদার্থগুলো আংশিক কেলাসাকার এবং রবারের তুলনায় বেশি শক্তিশালী হয়। তবে বেশ কিছু প্রাস্টিক আবার শক্ত, দৃঢ় ও অনমনীয়। যেমন- পলিস্ট্যাইরিন, ফেনল- ফরমালডিহাইড রেজিন, ইউরিয়াফরমালডিহাইড রেজিন ইত্যাদি। আবার কিছু প্লাস্টিক আছে যেগুলো নরম, কোমল ও নমনীয় যেমন- পলিইথিলিন, পলিপ্রোপিলিন বা পলি, পলিভিনাইল অ্যাসিটেট ইত্যাদি। পাস্টিক জাতীয় পদার্থগুলো রবারে তুলনায় কম প্রসারণশীল এবং এদের টানশক্তির মান সাধারণত 400 psi হতে 15000 psi হয়ে থাকে।
(গ) তন্তু (Fiber): এদের ক্ষেত্রে, এদের দৈর্ঘ্য ও ব্যাসের অনুপাত অন্ততপক্ষে 100 হতে হয়। তবে কৃত্রিমভাবে প্রস্তুত তন্তু ক্ষেত্রে এ মান 3000 পর্যন্ত হতে পারে। এক্ষেত্রে পলিমার অণুগুলো রৈকিক শৃঙ্খলযুক্ত হয়ে থাকে। এদের পলিমার অণুর বর্তমান হাইড্রোজেন বন্ধন অণুকে আরও সুদৃঢ় করে থাকে। যেমন- তুলা, রেশম, পশম, পাট, টেরিলিন, সিল্ক, নাইল প্রভৃতি তন্তু জাতীয় পলিমারের উদাহরণ।
প্রশ্ন: পলিমার কী? পলিমারের শ্রেণীবিভাগ আলোচনা কর । (Polymer and it’s classification)
উত্তর: গ্রিক শব্দ পলি (poly) অর্থ বহু এবং মেরোস (meros) অর্থ অংশ বা একক (unit)। সুতরাং ছোট একক অণু থেকে বৃহৎ অণু সৃষ্টির প্রক্রিয়াই হচ্ছে পলিমারকরণ। অর্থাৎ যে বিক্রিয়ায় একই যৌগের (যেমন- অসম্পৃক্ত হাইড্রোকার্বন) বহুসংখ্যক অণু পরস্পর যুক্ত হয়ে বৃহৎ অণু বিশিষ্ট নতুন যৌগ উৎপন্ন করে, সে বিক্রিয়াকে পলিমারকরণ বলে এবং উৎপন্ন যৌগকে পলিমার বা মূল যৌগকে মনোমর (monomer) বলে ।
যেমন- উচ্চ চাপে (1000 – 1200atm) ও 100 – 200°C তাপমাত্রায় সামান্য অক্সিজেনের উপস্থিতিতে 600 – 1000 ইথিন অণুর সংযোগে পলিথিন উৎপন্ন হয়।।
যেমন:
পলিমারকরণ বিক্রিয়া
(Polymerization reaction)
পলিমারকরণ বিক্রিয়া দু’প্রকার। যথা-
(ক)সংযোজন বা যুত বা চেইন পলিমারকরণ (Addition or chain polymerization) : যে পলিমারকরণ বিক্রিয়ায় কোন ক্ষুদ্র পদার্থের অপসারণ ব্যতীত মনোমার অণুসমূহ পরস্পর যুক্ত হয়ে দীর্ঘ শিকল পলিমার গঠন করে এবং গঠিত পলিমার এর আণবিক ভর মনোমারের আণবিক ভরের পূর্ণ গুণিতক হয় তাকে সংযোজন পলিমারকরণ বলে। সাধারণত, দ্বিবন্ধনযুক্ত যৌগসমূহ যেমন অ্যালকিন, প্রতিস্থাপিত অ্যালকিন ও ভিনাইল যৌগসমূহে সংযোজন পলিমারকরণ ঘটে।
(i) পলিথিন: 1000 – 1200 বায়ুচাপে ইথিন গ্যাসকে তরলীভূত করে সামান্য অক্সিজেনের উপস্থিতিতে 200°C উষ্ণতায় উত্তপ্ত করলে ইথিনের অসংখ্য অণু পরস্পর যুক্ত হয়ে যুত পলিমার পলিথিন গঠন করে। পলিথিন একটি সাদা, অস্বচ্ছ ও শক্ত প্লস্টিক পদার্থ।
nH2C = CH2→ -CH2-CH2-n এখানে, n = 600 – 1000
(ii) পলিপ্রপিন: হেপ্টেনে দ্রবীভূত প্রপিনকে 140 বায়ুচাপে TiCl3 এর উপস্থিতিতে 120°C উষ্ণতায় উত্তপ্ত করলে প্রপিনের অসংখ্য অণু যুক্ত হয়ে পলিপ্রপিন গঠন করে। এটিও শক্ত প্লাস্টিক।
(iii) পলিক্লোরোইথিন (পলিভিনাইল ক্লোরাইড) : ইথাইন (অ্যাসিটিলিন) ও শুষ্ক HCl থ্রাসের মিশ্রণকে 150–250°C উষ্ণতায় উত্তপ্ত মারকিউরিক ক্লোরাইডের উপর দিয়ে চালনা করলে উভয়ই সংযোজিত হয়ে ভিনাইল ক্লোরাইড বা ক্লোরোইথিন উৎপন্ন হয়। ক্লোরোইথিনকে জৈব পারঅক্সাইড যেমন, টারসিয়ারী বিউটাইল পারঅক্সাইডের উপস্থিতিতে উচ্চ চাপে উত্তপ্ত করলে পলিক্লোরোইথিন বা পলিভিনাইল ক্লোরাইড (PVC) উৎপন্ন হয়।
(iv) পলিফিনাইল ইথিন (পলিস্টারিন): ফিনাইল ইথিন বা স্টাইরিন একটি তরল পদার্থ । একে প্রায় 1000 বায়ুচাপে অথবা বিভিন্ন লুইস এসিডের (H2SO4, AlCl3) ইত্যাদি) উপস্থিতিতে উত্তপ্ত করলে পলি স্টাইরিন উৎপন্ন হয়। এদিকে বেনজিনের সঙ্গে ইথিলিনের সংযোগে ফ্রিডেলক্রাফট বিক্রিয়ায় স্টাইরিন পাওয়া যায়।
(v) পলি টেট্রাফ্লোরোইথিন (টেফলন) : টেট্রাফ্লোরোইথিনকে ফেনটন বিকারক অর্থাৎ FeSO4, ও H2O2, এর উপস্থিতিতে উত্তপ্ত করলে তা থেকে সংযজন পলিমারকরণ প্রক্রিয়ায় পলিটেট্রাফ্লোরোইথিন গঠিত হয়। এটি বাণিজ্যিকভঅবে টেফলন নামে পরিচিত। এটি একটি অদাহ্য, এসিড ও ক্ষারে নিষ্ক্রিয় এবং বিদ্যুৎ নিরোধী শক্ত ননস্টিকিং প্লাস্টিক।
পলিপ্রোপিনিল: এটি পলিথিনের চেয়ে শক্ত প্লাস্টিক। এটি দড়ি, কার্পেট, বোতল, পাইপ ইত্যাদি তৈরিতে ব্যবহৃত হয়।
পিভিসি: পিভিসি অত্যধিক শক্ত পুস্টিক। গৃহ নির্মাণের কাজে ব্যাপকভাবে ব্যবহৃত হয়। বৈদ্যুতিক সামগ্রী পানির পাইপ, কৃত্রিম চামড়া, রেইনকোট ও রেকর্ড তৈরিতে ব্যবহৃত হয়।
পলিস্টাইরিন: প্যাকেজিং উপাদান, ফোমের সামগ্রী ও তাপ নিরোধকের (Insulator) কাজে ব্যবহৃত হয়। কৃত্রিম রাবার উৎপাদনেও এটি ব্যবহৃত হয়।
টেফলন: এটি অত্যন্ত শক্ত প্লাস্টিক। টেফলন তাপ ও বিদ্যুৎ অপরিবাহী, ননস্টিক রান্নার প্যান, বৈদ্যুতিক ইনসুলেটর প্রভৃতি তৈরিতে এ পলিমার ব্যবহার হয়।
(খ) কনডেনসেশন পলিমার বা কো পলিমার: দুই বা ততোধিক ভিন্ন কার্যকরী মুলকযুক্ত মনোমার অণু পরস্পরের সাথে যুক্ত হয়ে এ জাতীয় পলিমার অণুর সৃষ্টি করে থাকে। তবে এ জাতীয় পলিমার অণুর সৃষ্টির সময় H2 0, NH3, অ্যালকোহল বা অন্য কোনো অণুর অপসারণ ঘটে থাকে। যেমন- নাইলন 6, 6, পলিএস্টার, পলিঅ্যামাইড, পলিফসফোনেট পলিকার্বনেট ইত্যাদি এ জাতীয় পলিমারের উদাহরণ।
(i) নাইলন 6, 6 : অ্যাডিপিক এসিড HOOC- CH24 – COOH ও হেক্সামিথিলিন ডাইঅ্যামিন H2N -CH26 – NH2) এ দুটি মনোমার অণু হতে পানির অপসারণের ফলে নাইলন 6, 6 পলিমার অণুর সৃষ্টি হয়।
(ii) পলিইর্থিলিন টেরিথ্যালেট : বেনজিন-1, 4-ডাই কার্বক্সিলিক এসিড বা থ্যালিক এসিড ও ইথেন 1, 2 ডাইঅল বা ইথিলিন গ্লাইকল এ দুটি মনোমার অণু হতে পানির অণুর অপসারণের ফলে পলিথিলিন টেরিথ্যালেট পলিমার অণুর সৃষ্টি হয়। এটি বাজারে ডেক্রন বা টেরিলন নামে পরিচিত।
(iii) ইউরিয়া ও মিথ্যান্যাল (H – CHO) এর ঘনীভবন পলিমারকরণ বিক্রিয়ায় ফরমিকা উৎপন্ন হয়।
একটি খুবই সুদৃঢ় থার্মোসেটিং পলিমার। এর দ্বারা বৈদ্যুতিক চকেট, মাস্টার গাম প্রস্তুত করা হয়ে থাকে।
মেলামাইন: প্রভাবক TiO2, এর উপস্থিতিতে ইউরিয়া বা কার্বামাইডকে উত্তপ্ত করলে মেলামাইন উৎপন্ন হয়। মেলামাইন হলো একটি পলি অ্যামাইড ক্রসলিংক থার্মোসেটিং পলিমার। প্রতিদিনের ব্যবহার্য কাপ, প্লেট, বাটি ইত্যাদি কোকারিজ প্রস্তুত করতে এর ব্যবহার খুবই ব্যাপক। আগুনরোধী কাপড়। প্রস্তুতিতে এর ব্যবহার আছে। মেলামাইনের একটি ক্ষতিকর ব্যবহারও আছে । অসাধু জনসাধারণ মেলামাইনকে বেবি মিলকের সাথে ভেজাল হিসেবে মিশ্রিত করে থাকে। ফলে এটি শরীরে প্রবেশ করে কিডনিতে পাথর সৃষ্টি করে। এটি থেকে উৎপন্ন সায়ানো ইউরিক এসিড কিডনিকে নষ্ট করে দেয়।
মেলাডুর: মেলাডুর হলো মেলামাইন ও মিথান্যাল এর ঘনীভবন পলিমার। মেলামাইন ও মিথান্যালকে উত্তপ্ত করলে সংযোজন বিক্রিয়ার মাধ্যমে প্রাথমিকভাবে মাধ্যমিক যৌগ উৎপন্ন হয়। এ মাধ্যমিক যৌগকে উত্তপ্ত করলে প্রতি দুই অণু হতে এক অণু পানির অপসারণের ফলে মেলামাইনের পলিমার মেলাডুর উৎপন্ন হয়।
পলিমারকরণ বিক্রিয়া : “ব্যাকেলাইট” প্লাস্টিক গঠন বিক্রিয়ার শর্ত ভেদে ফেনল ও মিথান্যাল এর বিভিন্ন কাঠামোর শাখাযুক্ত ত্রিমাত্রিক ঘনীভবন পলিমার উৎপন্ন হয়। যেমন- এসিড বা ক্ষারের উপস্থিতিতে ফেনলকে মিথান্যালের সাথে উত্তপ্ত করলে “ব্যাকেলাইট” নামক পাস্টিক এর বৃহৎ অণু উৎপন্ন হয়। ব্যাকেলাইট প্রাস্টিক দ্বারা গানের রেকর্ড ও টেলিফোন সেট তৈরি করা যায় । বৈদ্যুতিক মালামাল যেমন- পাগ, সকেট তৈরিতেও ইহা ব্যাপকভাবে ব্যবহৃত হয়।
প্লাস্টিসিটি
(Plasticity)
প্রশ্ন: থার্মোপ্লাস্টিক এবং থার্মোসেটিং প্লাষ্টিক বলতে কী বুঝ? (Thermoplastic and thermosetting plastic)
উত্তর : থার্মোপ্লাস্টিক গুলো তাপ প্রয়োগে নরম হয়ে গলে যায় এবং শীতল করলে পুনরায় পূর্বের মত কঠিন হয়। এ প্রক্রিয়া পুন:পুন করা যায় । এরা গঠনে সরল শিকল পলিমার। যেমন- পলিথিন পলিষ্টারিন ইত্যাদি। এরা দীর্ঘ শৃংখলযুক্ত এবং কম দৃঢ়।
অপরদিকে, থার্মোসেটিং পুষ্টিকগুলো প্রস্তুতকালে প্রথমবারে মত তরল থেকে শীতল করে, কঠিন করা যায়। এর পর একে বানানো যায় না। এরা গঠনে ক্রস লিংক পলিমার। যেমন- মেলামাইন, ব্যাকেলাইট, ইত্যাদি। এরা ত্রিমাত্রিকগঠনের এবং অধিক দৃঢ়।
প্রশ্ন: গ্লাইকোসাইড বন্ধন কী? (Glycosidic bond)
উত্তর: দুটি মনোস্যাকারাইড অণুর মধ্যে ঘনীভবন বিক্রিয়ার ফলে এক অণু পানি অপসারিত হয়ে ডাই স্যাকারাইড অণু গঠিত হয়। তখন উৎপন্ন ডাই স্যাকারাইড অণুর উভয় মনোস্যাকারাইড এর মধ্যে যে C-0-C নতুন বন্ধন সৃষ্টি হয় তাকে গ্লাইকোসাইড বন্ধন বলে। এটি দুই প্রকার ।
i) -গ্লাইকোসাইড বন্ধন: দুই অণু α-D গ্লুকোজের মধ্যে এক অণু পানি অপসারণের মাধ্যমে যে গ্লাইকোসাইড বন্ধন তৈরি হয়। তাকে গ্লাইকোসাইড বন্ধন বলে। এক্ষেত্রে বন্ধনটি একটি অণুর এক নং কার্বনের সাথে অপর অণুর 4 নং কার্বন মধ্যে বন্ধনটি গঠিত হয়। স্টার্চের মধ্যে গ্রকোজ অণুসমূহ পরস্পরের সাথে -গ্লাইকোসাইড বন্ধনের মাধ্যমে যুক্ত থাকে। যেমন-
ii) -গ্লাইকোসাইড বন্ধন: ২ টি-D গ্লোকোজে 1 ও 4 নং কার্বনের মাঝে এ বন্ধন গঠিত হয় ।
প্রশ্ন: স্টার্চ এবং সেলুলোজের গঠন এর মধ্যে পার্থক্য উল্লেখ কর। (The difference between the composition of starch and cellulose)
উত্তর: স্টার্চ হল α-D গ্লুকোজের একটি পলিমার। এটি সেলুলোজ অপেক্ষা বড় পলিমার । এটি অ্যামাইলেজ ও অ্যামাইলোপেকটিন নামক দুটি উপাদান দ্বারা গঠিত। অ্যামাইলোজ এর মধ্যে C-1, 4-α গ্লাইকোসাইড বন্ধন বিদ্যমান । কিন্তু অ্যামাইলোপেকটিন এর মধ্যে এবং C-1, 4 এর মাধ্যমে সরল শিকল এবং C-1, 6 এর মাধ্যমে শাখা শিকল গঠিত হয়। সেলুলোজ হল β-D গ্লুকোজের সরল পলিমার। যাতে C-1,4 B গ্লাইকো সাইডিক বন্ধন বিদ্যমান।
স্টার্চ হলো মানুষের খাদ্য। সেলুলোজ হল গরু ছাগলের খাদ্য। কারন এদের পাকস্থলীতে গুকোসিডেজ নামক এনজাইম উপস্থিতিতে থাকে যা সেলুলোজের -গ্লাইকোসাইডি বন্ধনকে ভাঙতে পারে। কিন্তু মানুষের পাকস্থলীতে এ ধরনের এনজাইম নেই।
প্রশ্ন: স্টার্চ আয়োডিনের সংস্পর্শে নীল বর্ণ ধারণ করে কেন? (Starch turns blue on contact with iodine)
উত্তর: স্টার্চের উপাদান অ্যামাইলোজ এর কারণে এটি নীল বর্ণ ধারণ করে। অ্যামাইলোজের গঠন প্যাচানো ফিতার মত । প্যাচানো অংশের ফাঁকা স্থানে আয়োডিন অণু আবদ্ধ হয়ে জটিল যৌগ গঠন করে। তখন আয়োডিন পরমাণুগুলোর বহি:স্তরের e- রুপান্তরের কারণে শক্তি শোষণ করে নীল বর্ণ তৈরি করে।
প্রশ্ন: পেপটাইড বন্ধন কী? (Peptide bond)
উত্তর: একটি অ্যামাইনো এসিড এর কার্যক্সিল মূলক এবং অন্য একটি অ্যামাইনো এসিডের অ্যামিন মূলকের সাথে বিক্রিয়ায় পানির অণুর অপসারণের মাধ্যমে যে অ্যামাইড বন্ধন গঠিত হয় তাকে পেপটাইড বন্ধন বলে। দুটি অ্যামাইনো এসিড অণু পরস্পরের সাথে যুক্ত হয়ে ডাই পেপটাইড বন্ধন, 50-100 টি অ্যামাইনো এসিড অণু যুক্ত হয়ে পেপটাইড বন্ধনের মাধ্যমে একটি প্রোটিন অণু গঠন করে। অর্থাৎ প্রোটিন হলো পলিপেপটাইড।
প্রশ্ন: জুইটার আয়ন কী?
উত্তর: অ্যামাইনো এসিডের অ্যামিনো মূলকটির ক্ষারীয় এবং কার্বোক্সিল মূলক এর অম্লধর্ম আছে । এদের মধ্যে অন্ত: অম্ল-ক্ষার বিক্রিয়ার যে উভয়ধর্মী আয়ন তৈরি করে তাকে জুইটার আয়ন বলে।
প্রশ্ন: আইসোইলেকট্রিক 𝒑𝑯 কী? (Isoelectric 𝒑𝑯)
উত্তর: একটি নির্দিষ্ট pH পর্যন্ত জুইটার আয়ন কোন ধরনের চার্জ বহন করে না। অর্থাৎ বৈদ্যুতিকভাবে নিষ্ক্রিয় থাকে তাকে ঐ অ্যামাইনো এসিডের আইসো ইলেকট্রিক pH বলে। প্রতিটি অ্যামাইনো এসিডের এক একটি নির্দিষ্ট pH মান আছে যার মাধ্যমে ঐ অ্যামাইনো এসিডকে শনাক্ত করা যায়।
প্রশ্ন: ইউরোট্রোপিন বা হেক্সামিন কী? (Urotropine or hexamine)
উত্তর: হেক্সামিথিলিন টেট্রাঅ্যামিনকে ইউরোট্রোপিন বলে । এটি একটি চাক্রিক যৌগ-
প্রস্তুতি: মিথান্যালের 40% জলীয় দ্রবণকে গায় NH3 দ্রবণের সাথে উত্তপ্ত করলে হেক্সামিন উৎপন্ন হয়।
6HCHO + 4NH3 ∆→ CH26N4 + 6H2O
ব্যবহার:- বাতজ্বর ও মূত্রাশয় রোগের ঔষধ তৈরীতে ব্যবহৃত হয়।
প্রশ্ন: জৈব যৌগের বিশুদ্ধতার মানদন্ডগুলো কী কী? (Criteria for the purity of organic compounds)
উত্তর : জৈব যৌগের বিশুদ্ধতার মানদন্ডগুলো হলো গলনাংক, স্কুটনাংক, ঘনত্ব, প্রতিসারংক ইত্যাদি। তবে কঠিন জৈব যৌগের ক্ষেত্রে গলনাংক এবং তরল জৈব যৌগের ক্ষেত্রে স্ফুটনাংককে বিশুদ্ধতার মানদন্ড হিসেবে ধরা হয়।
IR রশ্মির মাধ্যমে জৈবযৌগের কার্বনিল মূলক শনাক্তকরণ
(Carbonyl-based identification of organic compounds by IR rays)
IR রশ্মির মাধ্যমে জৈব যৌগে কার্যকরী মূলক শনাক্তকরণ পদ্ধতি বর্ণনা কর। (Method of identification of organic compounds using IR rays)
IR রশির তরঙ্গদৈর্ঘ্য হল: 2.5um থেকে 25um (λ)
এবং তরঙ্গ সংখ্যা হল v- : 4000cm-1 থেকে 400cm-1 (v- =1 )
এর মধ্যে 4000 – 1400cm-1 অঞ্চল কার্যকরী মূলক সনাক্তকরণে এবং 1400 – 650cm-1 অঞ্চল ফিঙ্গার প্রিন্ট অঞ্চল জৈব যৌগের অবলোহিত বর্ণালীকে % of Transmitance এর বিপরীতে তরঙ্গ সংখ্যায় অংকন করা হয়।
জৈব যৌগের সৃষ্ট IR বর্ণালিকে দুটি অংশে ভাগ করা যায়:
(১) আণবিক কাঠামোর কম্পনজনিত শোষণ ব্যান্ড অঞ্চল (Skeletal region) : এক্ষেত্রে – = (1400-650)cm-1 হয়। কাঠামো কম্পন ব্যান্ডকে (একাধিক ব্যান্ড হতে পারে) ফিঙ্গার প্রিন্ট অঞ্চল (Finger print region) বলা হয়। কারণ এ ব্যান্ডটি যৌগের নিজস্ব পরিচয়দায়ক এবং এ ব্যান্ড থেকে যৌগ অণুর গঠন প্রমাণ নমুনা যৌগের IR-বর্ণালির সাথে তুলনা করে শনাক্ত করা হয়। IR বর্ণালিতে সৃষ্ট নির্দিষ্ট ফ্রিকুয়েন্সির সিগন্যালকে ব্যান্ড বলে ।
(২) কার্যকারী মূলকের কম্পনজনিত শোষণব্যান্ড অঞ্চল (Functional groups region) : এক্ষেত্রে – = (1000-4000)cm-1 হয়। প্রতিটি কার্যকরী মূলকের নির্দিষ্ট তরঙ্গ-সংখ্যার পরিসরে শোষণ ব্যান্ড আছে। তাই ঐ সব তরঙ্গ সংখ্যার ব্যান্ড থেকে জৈব যৌগের নির্দিষ্ট কার্যকরীমূলক শনাক্ত করা যায়।
সাধারণত জৈব অণুতে স্থায়ী এবং পরিবর্তনশীল ডাইপোল মোমেন্ট থাকায় এটি IR সক্রিয় হয়। IR রশিার চেয়ে বেশি শক্তিযুক্ত UV ও দৃশ্যমান (Vis) রশ্মি শোষণের ফলে যৌগের আণবিক অরবিটালের ইলেকট্রন ও নি:সঙ্গ ইলেকট্রন উচ্চ শক্তিস্তরে স্থানান্তরের ফলে আণবিক UV-Vis বর্ণালি সৃষ্টি হয়। অপরদিকে যৌগের অণুস্থিত বিভিন্ন পরমাণুর সমযোজী বন্ধনের বিভিন্ন প্রকার কম্পন (Vibration) শক্তির পার্থক্য থেকে অণুটিতে ডাইপোল মোমেন্টের পরিবর্তন ঘটে। তখন সমযোজী অণুর ডাইপোল মোমেন্টের পরিবর্তন শক্তির সমতুল্য শক্তি IR রশ্মি থেকে শোষিত হয়। এর ফলে সৃষ্ট বর্ণালিকে IR শোষণ বর্ণালি বলে ।
সমযোজী বন্ধনে আবদ্ধ পরমাণুগুলো সর্বদা কম্পমান (Vibration) ও আবর্তনশীল (rotating) থাকে। যেমন H3C – CH3; অণুতে C – C বন্ধন বরাবর দুটি CH3 মূলক rotate করে। আবার প্রত্যেক পরমাণু এর বন্ধন বরাবর Vibrate করে। তখন সমযোজী বন্ধনটি পরমাণুর ভর ও বন্ধনের দৃঢ়তার ওপর নির্ভর করে নমনীয় (flexible) স্প্রিং এর মতো সরলরেখায় প্রসারণ (stretch) ও সংকোচন (contract) এবং কৌণিক পরিবর্তন যেমন bending, twisting, rocking ও wagging করে থাকে। আণবিক কম্পনের শক্তির পরিমাণ নির্ভর করে- (১) বন্ধনের নমনীয়তা, (২) কম্পনের প্রকৃতি ও (৩) পরমাণুর ভরের ওপর। পরমাণুর দুটি কক্ষপথের শক্তির পার্থক্যের মতো এক্ষেত্রেও প্রতিটি কম্পনের শক্তির পার্থক্য নির্দিষ্ট ফ্রিকুয়েন্সির তরঙ্গ শক্তিযুক্ত হয়, যা IR রশ্মির বিভিন্ন ফ্রিকুয়েন্সির সাথে মিল থাকে এবং তা IR এর 2.5 – 25μm তরঙ্গ দৈর্ঘ্য পরিসরে হয়।
IR এর শোষণের ফলে কোনরূপ ইলেকট্রনীয় স্থানান্তর না ঘটলেও সমযোজী বন্ধনে আবদ্ধ পরমাণু বা মূলকের কম্পনীয় উত্তেজনা সৃষ্টি করার মত সামর্থ্য রাখে। তবে একটি অণুতে উপস্থিত একাধিক কার্যকরী মূলক কেবলমাত্র অবলোহিত রশ্মির কিছু কিছু নির্ধারিত ফ্রিকুয়েন্সি শোষণ করতে পারে। এর ফলে পরমাণু সমূহের পরস্পরের সাপেক্ষে বিভিন্ন মাত্রার কম্পন দেখায়। কম্পন দুই ধরনের হতে পারে ।
১. প্রসারণ
২. বক্রকরণ বা ব্যান্ডিং (bending)
প্রসারণকে আবার দুইভাগে করা যায়।
১. প্রতিসম ।
২. অপ্রতিসম
চিত্র. পানির অণুর প্রসারিত এবং নমনিত কম্পন
বক্রকরণ অপেক্ষা প্রসারণের জন্য অধিক শক্তির প্রয়োজন হয়। তাই শুধুমাত্র প্রসারণের জন্য যে পরিমাণ শক্তিশোষিত হয় তার ক্ষেত্রে যে সকল রেখাগুলো পাওয়া যায়। সে রেখাগুলো দ্বারাই সাধারণত কার্যকরী মূলক শনাক্ত করা হয়। অধিকাংশ জৈব যৌগে কার্বনিল মূলক আছে। তাই, সর্বপ্রথম এ মূলকটি শনাক্ত করা হয়।
নিম্নরূপে বিভিন্ন কার্যকরী মূলক শনাক্ত করা যায়।
১. IR এর ক্ষেত্রে সর্বপ্রথম কার্বনিল মূলক শনাক্ত করা হয়। এর জন্য তরঙ্গসংখ্যার সীমানা হচ্ছে 1850 – 1650 cm-1। তবে বিভিন্ন কারণে এর সীমানা পরিবর্তন হতে পারে। যেমন-
(i) আবেশীয় প্রভাব
(ii) অনুরনন প্রভাব
(iii) H-বন্ধন প্রভাব
| অ্যালডি হাইড O||R – C – H | কিটোন O||R – C – R | কার্বক্সিলিক এসিড O||R – C – OH | এস্টার O||R – C – R – H | অ্যামাইড O||R – C – NH2 | এসিড হ্যালাইড O||R – C – Cl | এসিড অ্যানহাইড্রাইড O||R – C – O – C – R |
| 1725 – 1730Cm-1 | 1715 Cm-1 | 1710 Cm-1 | 1735 Cm-1 | 1690 Cm-1 | 1800 Cm-1 | ১ম – 1760 Cm-1২য় – 1810 Cm-1 |
এই চার্টের যৌগগুলো শুধুমাত্র কার্বনিল মূলকের জন্য তরঙ্গ সংখ্যা দেখান হয়েছে।
অ্যালডিহাইড শনাক্তকরণ: (-CO-H) (Aldehyde Identification (-CO-H)):
এক্ষেত্রে 1725 cm এর কাছাকাছি -CO- মূলকের জন্য একটি রেখা পাওয়া যায়। তবে C – H প্রসারণের জন্য 2750 cm-1 এবং 2850 cm-1 অঞ্চলে দুটি দুর্বল রেখা পাওয়া যায়। যা কিটোনের ক্ষেত্রে, অনুপস্থিত থাকে। C – H এর এ দুটি রেখার মাধ্যমে অ্যালডিহাইড এবং কিটোনের মধ্যে পার্থক্য করা যায় । HCHO, CH3CHO এর ক্ষেত্রে C = 0 প্রসারণের জন্য যথাক্রমে 1750 cm-1 এবং 1745 cm-1 এ শোষণ দেখায়।
চিত্র : বিউটানলের IR বর্ণালি
কিটোন শনাক্তকরণঃ (-CO- ) (Ketone Identification (-CO- ): এক্ষেত্রে কার্বনিল মূলকের উভয় পাশে অ্যালকাইল মূলকের +I ধর্মের কারনে >C=O মূলকটি তথা বন্ধনটি দুর্বল হয়ে পড়ে ফলে এক্ষেত্রে নিম্ন তরঙ্গ সংখ্যাতে তথা 1715 cm-1 এ কার্বনিল মূলকের জন্য একটি রেখা পাওয়া যায়।
Wavenumber/cm-1
চিত্রঃ প্রোপানোনের IR বর্ণালি
অ্যালকোহল শনাক্তকরণ: -C||-O-H (Alcohol identification -C||-O-H): অ্যালকোহলের ক্ষেত্রে C-O এবং O – H এর প্রসারণের জন্য দুটি রেখা পাওয়া যায়। C- O এর প্রসারণ কম্পঙ্কটি 1250 থেকে 1000 cm-1 সীমার মধ্যে থাকে। তবে O– H বন্ধনের প্রসারণের জন্য কম্পাঙ্কটি মূলত হাইড্রোজেন বন্ধন গঠনের উপর নির্ভর করে। যদি H বন্ধন না থাকে তাহলে 3650 থেকে 3600cm- এর মধ্যে একটি তীক্ষ্ম রেখা দেখা যায় কিন্তু H বন্ধন উপস্থিত থাকলে 3500 থেকে 3200cm-1 এর মধ্যে একটি প্রশস্ত চূড়া দেখা যায়। কারণ H বন্ধন ০ – H বন্ধনকে দুর্বল করে দেয়।
| যৌগ | C -O | O-H |
| 1°alc | 1050cm-1 | 3690 |
| 2°alc | 1100cm-1 | 3630 |
| 3°alc | 1150cm-1 | 3620 |
| ফেনল | 1220 | 3610 |
তরঙ্গ সংখ্যা, v (cm-1)
চিত্রঃ ইথানলের IR বর্ণালি
তরঙ্গ সংখ্যা, v (cm-1)
চিত্রঃ ফেনেলের অবলোহিত IR বর্ণালি
কার্বক্সিলিকমূলক সনাক্তকরণ : -CO -O-H (Carboxylic identification -CO -O-H)
এক্ষেত্রে -CO – , C – ০, ০ – H এর জন্য তিনটি রেখা পাওয়া যায়। এর মধ্যে এদের তরঙ্গ সংখ্যা যথাক্রমে 1730 – 1700, 1320 – 1210 এবং 3400 – 2400 cm-1. অনুরণন প্রভাব দ্বারা =C=O এর কার্বন অক্সিজেন দ্বি বন্ধন একক বন্ধনে রূপান্তরিত হয়। তাই অ্যালডিহাইডের চেয়ে কম তরঙ্গসংখ্যা অঞ্চলে জৈব এসিডের C =O প্রসারণ ব্যান্ড পাওয়া যায়।
লঘু দ্রবণে জৈব এসিডের C =O প্রসারণ ব্যান্ড 1725 – 1700 cm-1 অঞ্চলে পাওয়া যায়। তবে জৈব এসিডের নিম্নতর সদস্য (যেমন CH3COOH) গাঢ় দ্রবণে ডাইয়ার গঠন করায় C =O বন্ধন দুর্বল হয়ে পড়ে এবং C =O প্রসারণ। ব্যান্ড ডানদিকে সরে 1710 cm-1 অঞ্চলে পাওয়া যায় ।
CH3COOH এর ডাইমার (1710 cm-1)
ইথানৈয়িক এসিড
অ্যামাইড (R – CO – NH2) (Amide (R – CO – NH2)): অ্যামাইডে অনুরণন প্রভাব দ্বারা C=O এর দ্বিবন্ধন একক বন্ধনে পরিণত হয়, তাই C =O প্রসারণ ব্যান্ড সাধারণ C =O প্রসারণ অপেক্ষা ডানদিকে সরে কম তরঙ্গ সংখ্যা অঞ্চলে পাওয়া যায় । য্যামাইডের C =O প্রসারণ ব্যান্ড অঞ্চল হলো 1670 – 1640 cm-1
এস্টার (R – CO -O – R) (Ester (R – CO -O – R)): সাধারণ এস্টার C =O প্রসারণ ব্যান্ড পাওয়া যায় 1750 – 1730 cm-1 অঞ্চলে এস্টারের অ্যালকক্সি অক্সিজেনের ঋণাত্মক আবেশীয় প্রভাবে C =O বন্ধন সবল হয়ে পড়ে; যে কারণে এস্টারের C =O প্রসারণ ব্যান্ড অ্যালডিহাইড অপেক্ষা বামদিকে সরে যায়।
এসিড হ্যালাইড (R – CO – CI) : (Acid Halide (R – CO – CI)): এসিড হ্যালাইডের কার্বনিল কার্বনের সাথে অধিক তড়িৎ ঋণাত্মক মৌল হ্যালোজেন থাকায় ঋণাত্মক আবেশীয় প্রভাবে C =O বন্ধন সবল হয়। এ কারণে হ্যালাইডের C =O প্রসারণ ব্যান্ড অ্যালডিহাইড, এস্টার ও এসিড অপেক্ষা বামদিকে সরে যায়। R-C0 – Cl এর C =O প্রসারণ ব্যান্ড প্রায় 1800cm-1 অঞ্চলে পাওয়া যায়।
এসিড অ্যানহাইড্রাইড (R – CO -O – C0 – R) : (Acid Anhydride (R – CO -O – C0 – R) ): এসিড অ্যানহাইড্রাইডে সর্বদা দুইটি C =O প্রসারণ ব্যান্ড পাওয়া যায়। অ্যানহাইড্রাইড C =O এর প্রতিসম এবং অপ্রতিসম প্রসারণ ঘটে। প্রতিসম প্রসারণের জন্য 1760 cm-1 এবং অপ্রতিসম প্রসারণের জন্য 1850 cm-1 অঞ্চলে ব্যান্ড পাওয়া যায়।
(প্রতিসম প্রসারণ) 1760 cm-1
(অপ্রতিসম প্রসারণ) 1810 cm-1
প্লাস্টিসিটি পদার্থের এমন একটি গুরুত্বপূর্ণ ধর্ম যা শিল্প এবং প্রযুক্তির বহু ক্ষেত্রে অপরিহার্য।
একই বিক্রিয়কের অসংখ্য অণু যখন যুক্ত হয়ে পলিমার তৈরী করে তখন তাকে যুত বা সংযোজন বিক্রিয়া (Addition polymerization) বলে। যুত পলিমারকরণ বিক্রিয়ায় সাধারণত দ্বিবন্ধন বিশিষ্ট কোন অ্যালকিন অণু মনোমার হিসেবে বিক্রিয়া করে। এই বিক্রিয়ার সময় কোন প্রকার ক্ষুদ্র অণুর অপসারণ হয় না।
ইথিলিন থেকে পলিথিলিন তৈরীর যুত পলিমারকরন বিক্রিয়া
যখন একাধিক যৌগের অসংখ্য অণু পরস্পরের সাথে বিক্রিয়া করে পলিমার তৈরী করে তখন তাকে ঘনীভবন পলিমারকরন বিক্রিয়া বলে। ঘনীভবন বিক্রিয়ায় সাধারনত অ্যালকোহল, অ্যালডিহাইড, অ্যামিন এবং জৈব অ্যাসিডের অণু মনোমার হিসেবে ব্যবহার করা হয়ে থাকে। এই বিক্রিয়ার সময় জল ( H2O) এবং কার্বন ডাই অক্সাইড (CO2) অণুর অপসারন হয়ে থাকে। নাইলন পলিমার ঘনীভবন পলিমারকরন বিক্রিয়ার দ্বারা তৈরী করা হয়। এছাড়াও একাধিক প্রাকৃতিক পলিমার (স্টার্চ, সেলুলোজ ইত্যাদি) ঘনীভবন পলিমারকরন পক্রিয়ার দ্বারা সৃষ্টি হয়ে থাকে।
নাইলন তৈরীর ঘনীভবন পলিমারকরন বিক্রিয়া
গ্লাইকোসাইড বন্ধন হলো এক প্রকার কোভ্যালেন্ট বন্ধন যা কার্বোহাইড্রেট মোনোমারগুলিকে যুক্ত করে পলিস্যাকারাইড তৈরি করে। এটি গঠিত হয় যখন একটি শর্করা অণুর হাইড্রক্সিল গ্রুপ অন্য শর্করা অণুর বা অ-শর্করা অংশের সাথে যুক্ত হয়।
বৈশিষ্ট্য:
উদাহরণ:
পেপটাইড বন্ধন হলো একটি বিশেষ ধরনের অ্যামাইড বন্ধন যা অ্যামিনো অ্যাসিড মোনোমারগুলিকে যুক্ত করে প্রোটিন বা পলিপেপটাইড তৈরি করে। এটি গঠিত হয় যখন এক অ্যামিনো অ্যাসিডের \(-COOH\) গ্রুপ এবং অন্য অ্যামিনো অ্যাসিডের \(-NH_2\) গ্রুপের মধ্যে জল অপসারণের মাধ্যমে।
বৈশিষ্ট্য:
উদাহরণ:
| প্যারামিটার | গ্লাইকোসাইড বন্ধন | পেপটাইড বন্ধন |
|---|---|---|
| গঠনকারী একক | শর্করা | অ্যামিনো অ্যাসিড |
| বন্ধনের ধরন | কোভ্যালেন্ট | অ্যামাইড |
| উদাহরণ | সেলুলোজ, গ্লাইকোজেন | প্রোটিন, পলিপেপটাইড |
| ভাঙার পদ্ধতি | এনজাইমেটিক হাইড্রোলাইসিস | এনজাইমেটিক হাইড্রোলাইসিস |
গ্লাইকোসাইড বন্ধন কার্বোহাইড্রেট পলিমার এবং পেপটাইড বন্ধন প্রোটিন পলিমারের গঠনে গুরুত্বপূর্ণ ভূমিকা পালন করে। উভয় বন্ধনই জৈব রসায়নে এবং জীবের জৈব রাসায়নিক ক্রিয়াকলাপে অপরিহার্য।
গ্লাইকোসাইড বন্ধন কী? এর প্রকারভেদ ও উদাহরণ দাও।
দুটি মনোস্যাকারাইড অনুর মধ্যে ঘনীভবন বিক্রিয়া ঘটলে দুটি –OH মুলক থেকে এক অনু পানি অপসারিত হয়ে একটি ডাইস্যাকারাইড উৎপন্ন করে। এই ডাই স্যাকারাইড গঠনের সময় দুটি মনোস্যাকারাইডের মধ্যে যে কার্বন-অক্সিজেন-কার্বন (C-O-C) বন্ধন সৃষ্টি হয় তাকে গ্লাইকোসাইড বন্ধন বলে।
ইহা দুই প্রকার : ১। আলফা গ্লাইকোসাইড বন্ধন : alfa-D গ্লুকোজে ঘটে থাকে এবং স্টার্চ গঠন করে।
২। বেটা () গ্লাইকোসাইড বন্ধন : beta-D গ্লুকোজে ঘটে থাকে এবং সেলুলোজ গঠন করে।

পেপটাইড (Peptide):
একটি আলফা অ্যামিনো এসিডের কারবক্সি গ্রুপের সাথে আরেকটি আলফা অ্যামিনো এসিডের অ্যামিনো ঘনিভবন বিক্রিয়ায় যে বিশেষ অ্যামাইড বন্ধন সৃষ্টি হয় তাই পেপটাইড বন্ধন। সহজ ভাবে বলা যায় যে, অ্যামিনো এসিড অনুতে অ্যামিনো মুলক (-NH2) ও কার্বক্সিল মুলক (-COOH) উভয়ই বর্তমান থাকে। একটি অ্যামিনো এসিডের কার্বক্সিল মুলকের সাথে অন্য অ্যামিনো এসিডের অ্যামিনো মুলকের বিক্রিয়ায় উৎপন্ন –NHCO- বন্ধনকে পেপটাইড বন্ধন বলে। প্রোটিনের ভিতরে অ্যামিনো অ্যাসিডরা এই বন্ধনেই আবদ্ধ থাকে। রেসোনান্সের ফলে পেপটাইড বন্ধনে ৪০% দ্বিবন্ধন বৈশিষ্ট্য (৬০% একবন্ধন) আছে।
উদাহরণস্বরূপ, যখন একটি পেপটাইড দুটি অ্যামিনো অ্যাসিড গঠিত হয়, তখন এটি ডাইপ্পপটাইড বলে। যেহেতু তিনটি অ্যামিনো এসিড একত্রিত করে ত্রিভুজ প্রস্তুত করা হয়, তাই চারটি অ্যামিনো এসিডগুলি টিট্রেপপটাইডস উৎপাদনে মিলিত হয়। এই ধরনের ছাড়াও, অলিগোপেপেটেড (২ -২0 অ্যামিনো এসিড গঠিত) এবং পলিপাইটিয়েড রয়েছে, যা অনেক পেপারাইড (কম)।
100 এর চেয়ে বেশি) পেপটাইডের সবচেয়ে গুরুত্বপূর্ণ চরিত্রগত বৈশিষ্ট্য পরিমাণ এবং অ্যামিনো অ্যাসিডগুলির ক্রম অনুসারে নির্ধারণ করা হয়। সর্বাধিক পপটাইদগুলির প্রাথমিক কাজ শরীরের এক জায়গায় থেকে অন্য জায়গায় বায়োকেমিক্যাল বার্তা প্রেরণ করে কার্যকর যোগাযোগের অনুমতি দেয়।
প্রোটিন (Protein):
প্রোটিন (Protein) হলো অ্যামিনো এসিড দিয়ে তৈরি, যা কোষের “বিল্ডিং ব্লকস” হিসাবে কাজ করে। প্রেটিন শরীরে অনেকগুলি গুরুত্বপূর্ণ ভূমিকা পালন করে যেমন: প্রোটিন কোষগুলিতে বেশিরভাগ কাজ করে এবং দেহের টিস্যু এবং অঙ্গগুলির গঠন, কার্যকারিতা এবং নিয়ন্ত্রণের জন্য এটি খুবই প্রয়োজনীয়। মাংস, মাছ, হাঁস-মুরগি, ডিম, শিং এবং দুগ্ধজাত খাবারের মতো অনেক খাবারেই প্রোটিন পাওয়া যায়। প্রোটিন সুস্বাস্থ্যের জন্য অত্যন্ত গুরুত্বপূর্ণ।
আমরা জানি খাদ্যের ছয়টি উপাদান রয়েছে তার মধ্যে প্রোটিন খুবই গুরুত্বপূর্ণ। প্রোটিন ছাড়া কোনো প্রাণীর অস্থিত্ব কল্পনা করা সম্ভব নয়।তাই পুষ্টিবিজ্ঞানে প্রোটিনকে সকল প্রাণের প্রধান উপাদান হিসেবে গণ্য করা হয়। সব প্রোটিনই কার্বন,হাইড্রোজেন, অক্সিজেন ও নাইট্রোজেন দিয়ে গঠিত। প্রোটিনকে ক্ষুদ্র ক্ষুদ্র অংশে ভাঙলে প্রথমে এমাইনো এসিড পরে কার্বন,হাইড্রোজেন ইত্যাদি মৌলিক পদার্থ পাওয়া যায়।
উৎসগত দিক দিয়ে প্রোটিন দুই ধরণের যথাঃ১.উদ্ভিজ্জ প্রোটিন। যে প্রোটিনগুলো উদ্ভিদ জগৎ থেকে পাওয়া যায় তাকে উদ্ভিজ্জ প্রোটিন বলে। ও ২.প্রাণীজ প্রটিন। যে প্রোটিন গুলো প্রাণী জগৎ থেকে পাওয়া যায় তাকে প্রাণীজ প্রোটিন বলে।
পেপটাইড এবং প্রোটিনের মধ্যে পার্থক্য:
প্রোটিন (Protein) হলো অ্যামিনো এসিড দিয়ে তৈরি, যা কোষের “বিল্ডিং ব্লকস” হিসাবে কাজ করে। পেপটাইড এবং প্রোটিনের মধ্যে পার্থক্য নিম্নরূপ-
১। পেপটাইডগুলি অ্যামিনো অ্যাসিডের ছোট রৈখিক চেইন। অন্যদিকে প্রোটিন অ্যামিনো অ্যাসিডের দীর্ঘ চেইন।
২। বেশিরভাগ অ্যামিনো অ্যাসিড পেপটাইড বন্ধনের মাধ্যমে পেপটাইড তৈরি করতে একত্রিত হয়। অন্যদিকে কিছু পেপারাইড প্রোটিন অণু তৈরির সাথে যুক্ত থাকে।
৩। সাধারণত, প্রোটিনগুলির স্থিতিশীল তিনটি মাত্রিক গঠন রয়েছে। অন্যদিকে পেপটাইডগুলি একটি স্থিতিশীল তিন-মাত্রিক কাঠামোর মধ্যে সংগঠিত হয় না।
৪। পেপটাইডের দৈর্ঘ্য আনুমানিক 100 এমিনো এসিডের চেয়ে কম। অন্যদিকে প্রোটিন এর দৈর্ঘ্য 100 এমিনো এসিডের চেয়ে বেশি। (ব্যতিক্রম আছে; এইভাবে, পার্থক্যগুলি অণুর ফাংশনের উপর নির্ভর করে, তার আকারের পরিবর্তে)
৫। পেপটাইডের ম্যাক্রোমুলুলুলিস হিসাবে বিবেচনা করা হয়। অন্যদিকে প্রোটিনগুলিকে ম্যাক্রোমুলুলুলিস হিসাবে বিবেচনা করা হয়।
৬। পেপারাইডগুলিতে, অ্যামিনো অ্যাসিডের কেবলমাত্র চেইনগুলি হাইড্রোজেন বন্ড তৈরি করে। অন্যদিকে প্রোটিন মধ্যে, না শুধুমাত্র পাশ চেইন, কিন্তু পেপটাইড গ্রুপ, হাইড্রোজেন বন্ড গঠন। এই হাইড্রোজেন বন্ড জল বা অন্যান্য পেপটাইড গ্রুপ সঙ্গে হতে পারে।
৭। সব প্যাটারাইডগুলি রৈখিক চেইন হিসাবে বিদ্যমান থাকে। অন্যদিকে প্রোটিন প্রাথমিক, সেকেন্ডারি, ত্রিমাত্রিক এবং চতুর্ভুজাকৃতির হিসাবে বিদ্যমান হতে পারে।
উদ্ভিদ বা প্রাণী দেহের বেশিরভাগ অংশ জৈব যৌগ দিয়ে গঠিত হয়। তাই জীবজগতের জীবন ক্রিয়ায় জৈব যৌগ বা রসায়নের গুরুত্ব অতুলনীয়। জীবনকে অব্যাহত রাখার জন্য জীবদেহের পুষ্টিসাধন, বৃদ্ধি, সংরক্ষণ, ক্ষয়পূরণ, বংশধারা, জীবের জন্ম, চলনশক্তি, দেহের মধ্যে নানা রাসায়নিক বিক্রিয়া ইত্যাদির প্রয়োজন হয়। জীবনের এই প্রয়োজনগুলো জৈব যৌগের মাধ্যমেই পূরণ হয়। তাই জীবন ক্রিয়ায় জৈব যৌগের ভূমিকা আলোচনা করা অত্যাবশ্যকীয়।
নিচে জৈব যৌগের গুরুত্ব সম্পর্কে পয়েন্ট আকারে আলোচনা করা হলো
১. দেহের পুষ্টি, বৃদ্ধি ও গঠনে জৈব যৌগের ভূমিকা
দেহের পুষ্টি বৃদ্ধি গঠন করে প্রতিরোধের জন্য আমরা যেসব খাদ্য খেয়ে থাকি তাদেরকে প্রধানত তিনটি ভাগে ভাগ করা যায়। আর আমরা যা কিছু খাদ্য গ্রহণ করে থাকি তা সবই জৈব যৌগ। যথা
ক) কার্বোহাইড্রেট
আমাদের খাদ্যের প্রধান উপাদান হলো জৈব যৌগ। চাল গম আলু ভুট্টা প্রভৃতির মূল উপাদান হলো শ্বেতসার জাতীয় পদার্থ।আখের চিনি মধু বা ফল থেকে চিনি জাতীয় পদার্থ বা কার্বোহাইড্রেট আমরা গ্রহণ করি প্রতিনিয়ত। এইসব খাদ্য অন্ত্রের রস যারা জীর্ণ হয়ে রাসায়নিক বিক্রিয়ার দ্বারা দ্রাক্ষা শর্করা বা গ্লুকোজে পরিণত হয়ে রক্তের সঙ্গে মিশে যায় এবং দেহের পুষ্টি সাধন করে।
খ) আমিষ বা প্রোটিন জাতীয় খাদ্য
দেহের গঠন এবং ক্ষয়প্রাপ্ত কোষের পূনর্গঠনের জন্য আমিষ জাতীয় খাদ্য যেমন মাছ, মাংস, ছানা, দুধ, নানা রকম ডাল প্রভৃতির প্রয়োজন। এই জাতীয় খাদ্যের প্রধান উপাদান হলো প্রোটিন। এর মধ্যে কার্বন, হাইড্রোজেন, অক্সিজেন এবং নাইট্রোজেন থাকে। প্রটিন ইন্ধনরূপে ব্যবহৃত হয়ে দেহে শক্তি যোগায়।
গ) স্নেহ জাতীয় পদার্থ
নারকেল তেল, সরষের তেল, বাদামের তেল, ঘি, মাখন যা আমরা খাদ্য হিসেবে গ্রহণ করি সেগুলি সব স্নেহ জাতীয় পদার্থ। এগুলি সবই জৈব পদার্থ। এই জাতীয় খাদ্য দেহের শক্তি উৎপন্ন করে। ভিটামিন দেহের গঠন সংরক্ষণ এবং ক্ষয়পূরণে অপরিহার্য। ভিটামিনও জৈব পদার্থ ছাড়া আর কিছু নয়।
২. এনজাইম হিসেবে জৈব যৌগের গুরুত্ব
জীবদেহের মধ্যে রাসায়নিক বিক্রিয়া অবিরাম ঘটে চলেছে। এই বিক্রিয়া গুলি ঘটায় কতকগুলি জৈব অনুঘটক বা এনজাইম। এই এনজাইমগুলি জটিল জৈব।
৩. হরমোন
দেহের নানা গ্রন্থি থেকে বিভিন্ন হরমোন নিঃসৃত হয়। দেহের স্বাভাবিক এবং সুষম বৃদ্ধির জন্য হরমোনের ক্রিয়া খুব গুরুত্বপূর্ণ। এইসব হরমোনগুলি সবই জৈব যৌগ।
৪. জিন হলো জীবের বংশ পরম্পরা ধারক ও বাহক। জিন হল জৈব যৌগ। এই জিনের মধ্যে থাকে ডিঅক্সিরাইবো নিউক্লিক অ্যাসিড বা ডিএনএ এবং রাইবোনিউক্লিক অ্যাসিড বা আরএনএ। এই দুই রকম নিউক্লিক অ্যাসিড জীবনের ধারাকে অক্ষুন্ন রাখে।
৫. প্রাণীদেহের চলাচল করার জন্য এবং দেহের পেশী সঞ্চালন করার জন্য যে শক্তি দরকার হয় তাই স্থিতি শক্তি হিসেবে দেহের মধ্যে জমা থাকে। দেহে এই স্থিতিশক্তি জমা থাকে একটি জৈব যৌগের মধ্যে— যার নাম এডিনোসিন ট্রাই ফসফেট বা এটিপি। এই এটিপি থেকেই জোনাকি পোকার দেহে আলোর সৃষ্টি হয় এবং সমুদ্রের বৈদ্যুতিক মাছের দেহে তড়িৎ শক্তি সৃষ্টি হয়।
৬. হিমোগ্লোবিন একটি জৈব যৌগ
দেহের প্রতিটি কোষে অক্সিজেন বয়ে নিয়ে যায় হিমোগ্লোবিন; এই হিমোগ্লোবিন প্রোটিন জাতীয় জৈব যৌগ।
৭. মানুষের স্বাচ্ছন্দ বিধানে ব্যবহৃত নানান জৈব যৌগ
মানুষের স্বাচ্ছন্দ বিধানের সাবান, বিভিন্ন অঙ্গরাগ ও রঞ্জক পদার্থ, কৃত্রিম সিল্ক, নাইলন, টেরিলিন প্রভৃতি আবিষ্কার জৈব রসায়নের অবদান। এছাড়া পেট্রোল, কেরোসিন, ডিজেল, প্রাকৃতিক গ্যাস প্রভৃতি জৈব যৌগ জ্বালানি হিসাবে সভ্যতায় যুগান্তর তৈরি করেছে।
৮. রোগ নিরাময়ে জৈব যৌগ
নানারকম জৈব যৌগ রোগ নিরাময়ের জন্য ব্যবহৃত হয়। যেমন ম্যালেরিয়ার কুইনাইন, নিউমোনিয়ায় পেনিসিলিন, যক্ষায় স্ট্রেপটোমাইসিন, টাইফয়েডে ক্লোরোমাইসিটিন প্রভৃতি। ক্লোরোফরম, ইথার প্রভৃতি চেতনানাশক পদার্থ অস্ত্রোপচারেরকে যন্ত্রণা শুন্য করেছে।
১. প্রাকৃতিক চক্র বজায় রাখা:
জৈব যৌগ, যেমন কার্বোহাইড্রেট, প্রোটিন, এবং লিপিড, প্রাকৃতিক চক্র যেমন কার্বন চক্র ও নাইট্রোজেন চক্রের অংশ। এগুলো পরিবেশে জীবের জন্য শক্তি এবং পুষ্টির উৎস হিসেবে কাজ করে।
২. বায়োমাস এবং শক্তি উৎপাদন:
জৈব যৌগের মাধ্যমে উদ্ভিদ এবং অন্যান্য জীব বায়োমাস তৈরি করে, যা জ্বালানি, যেমন বায়োগ্যাস ও বায়োডিজেল উৎপাদনে ব্যবহৃত হয়।
৩. দূষণ নিয়ন্ত্রণ:
জৈব যৌগের ভিত্তিতে তৈরি বায়োডিগ্রেডেবল প্লাস্টিক পরিবেশ দূষণ কমাতে সাহায্য করে। এছাড়া জৈব সার মাটির উর্বরতা বাড়াতে এবং রাসায়নিক সার কমাতে গুরুত্বপূর্ণ ভূমিকা পালন করে।
১. খাদ্য:
জৈব যৌগ খাদ্য উৎপাদনে প্রধান ভূমিকা পালন করে। কার্বোহাইড্রেট, প্রোটিন, লিপিড, এবং ভিটামিন মানবদেহের পুষ্টি ও শক্তি চাহিদা পূরণে অপরিহার্য।
২. স্বাস্থ্য:
জৈব যৌগ থেকে তৈরি ওষুধ, যেমন অ্যান্টিবায়োটিক, ভ্যাকসিন, এবং ভিটামিন, জনস্বাস্থ্য উন্নত করে।
৩. কৃষি:
জৈব সার এবং পেস্টিসাইড কৃষি উৎপাদন বৃদ্ধি ও পরিবেশ সংরক্ষণে সহায়তা করে। এটি কৃষকদের আর্থ-সামাজিক উন্নয়নেও ভূমিকা রাখে।
৪. শিল্প:
জৈব যৌগ থেকে তৈরি পণ্য, যেমন কাপড়ের জন্য পলিমার, রং, এবং কসমেটিকস, মানুষের দৈনন্দিন জীবনের মান উন্নত করে।
জৈব যৌগ পরিবেশ এবং সমাজে অত্যন্ত গুরুত্বপূর্ণ ভূমিকা পালন করে। প্রাকৃতিক চক্র থেকে শুরু করে স্বাস্থ্য, খাদ্য, এবং শিল্পে এর বহুমুখী ব্যবহার মানুষের জীবনযাত্রাকে সহজ ও টেকসই করে তুলেছে।
Read more